Почему важно понимать, как работает кардиостимулятор сердца? Ответ на вопрос, во многом зависит как раз от конструкции и режима работы ЭКС. Прибор работает по следующей схеме (принципу):
- отслеживает ритм сердца, и если возникает редкий или неправильный ритм с пропуском сокращений, посылает через электрод импульс к сердцу;
- если ритм нормальный, ЭКС находится в состоянии покоя – у разных людей аппарат работает по-разному: у кого-то постоянно, у кого-то выключается;
- посылает импульс к предсердию и правому желудочку, – правому и левому желудочку, правому предсердию;
- частотно-адаптивные стимуляторы (R-типа) имеют сенсорные датчики, которые реагируют на изменения в организме (повышение температуры, активность нервной системы, физическую активность и т.д.), и согласно программе выбирают режим работы;
- от прибора и несет обратно информацию от сердца к микрочипу ЭКС.
Принцип работы электрокардиостимуляторов примерно одинаков – и неплохо раскрывается на следующих видео:
Некоторые модели стимуляторов оснащены устройствами записи режимов работы сердца. Врачи могут ознакомиться с этими записями при плановом контроле настроек ИВР. Однако такие аппараты, как правило, на одном заряде батареи работают меньше (т.к. заряд расходуется и на обеспечение энергией записывающих функций). Прибор регистрирует желудочковые и предсердные нарушения ритма сердца: мерцание и трепетание предсертий, желудочковые и наджелудочковые тахикардии, фибрилляции желудочков.
Как работает кардиостимулятор: постоянно или выключается – нужно узнавать непосредственно у лечащего врача. По факту, первое время это будет даже ощущаться – особо хорошо при лежании на левом боку (или на правом – если ЭКС имплантирован с правой стороны): ощущение гудения. Проходит достаточно быстро – через месяц-другой уже совершенно не будет чувствоваться (хотя может проявляться вновь и вновь, например, после физической активности – у меня было после заплыва на 800 – 1000 м).
Для лечения сердечных блокад электроды устанавливаются в правое предсердие или правый желудочек, либо в обе полости (рис.3,4).
 рис.3
(электрод в полости правого желудочка).
рис.3
(электрод в полости правого желудочка).
 рис.4
(электроды в полости правого предсердия и правого желудочка).
рис.4
(электроды в полости правого предсердия и правого желудочка).
Предсердный электрод фиксируют обычно к межпредсердной перегородке, желудочковый - к верхушке правого желудочка. Подобный вариант фиксации, возможно, не является оптимальным с точки зрения распространения электрического возбуждения и сокращения камер сердца, однако механическое крепление электродов (что крайне важно) получается максимально надежным. При имплантации ИПК с функцией кардиовертера-дефибриллятора локализация желудочкового электрода будет такой же .
При ресинхронизирующей терапии расположение "правых" электродов то же; в левый желудочек электрод проводится через расположенный в правом предсердии коронарный синус (устье венозной системы левого желудочка), далее по системе вен электрод доводится до оптимального (с точки зрения кардиостимуляции) места левого желудочка и фиксируется (рис.5).
 рис.5
(электроды в обоих желудочках и в правом предсердии).
рис.5
(электроды в обоих желудочках и в правом предсердии).
Что касается фиксирующих элементов электродов, то они бывают пассивные (усики) и активные ("как штопор для бутылки"); последние вкручиваются в эндокард (рис.6,7).
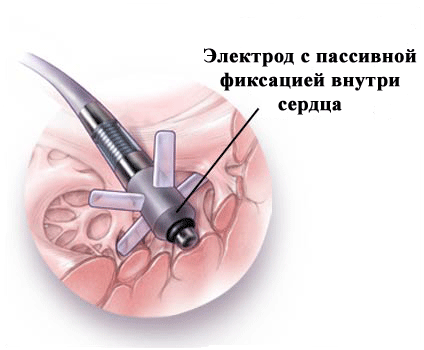 рис.6.
рис.6.
 рис.7.
рис.7.
Чтобы понять, как работают ИПК рассмотрим конкретные примеры. На рис. 8 представлена ЭКГ больной, страдавшей необъяснимыми обмороками . После проведения Холтеровского мониторирования ЭКГ причина синокопов была установлена - спорадически возникающие блокады сердца.

Ей имплантировали кардиостимулятор, после чего обмороки прекратились. На рис.9 запечатлен ЭКГ-фрагмент этой же пациентки в момент срабатывания кардиостимулятора "по требованию".

Еще один фрагмент ЭКГ (рис.10) больной, страдавшей до имплантации кардиостимулятора обмороками.

В настоящее время все кардиостимуляторы программируются в режиме "подстраховки" (по требованию, Demand ). То есть кардиостимулятор включается только в момент появления сердечной паузы определенной продолжительности, а приоритетными (для самого кардиостимулятора) являются собственные сокращения сердца, которые гораздо выгоднее для внутрисердечной гемодинамики (Что лучше: естественное распространение импульса или из верхушки правого желудочка? Ответ очевиден). Другое дело, что собственная сердечная проводимость может быть настолько угнетена (тотальные или субтотальные сердечные блокады), что почти все время работа сердца будет подчинена кардиостимулятору. Кроме того, полная зависимость от кардиостимулятора наблюдается в случае целенаправленной абляции какого-то критического участка проводящей системы (например, абляция АВ-узла при тахисистолической фибрилляции предсердий), что приводит к абсолютной невозможности естественного распространения электрического импульса.
Срабатывание кардиовертера-дефибриллятора происходит в момент возникновения желудочковой тахикардии (сокращение желудочков с немотивированно высокой частотой) или фибрилляции желудочков ("сердечный хаос", клиническая смерть). Данные аритмии обусловлены циркуляцией в желудочке одной или нескольких электрических волн. Кардиовертер-дефибриллятор купирует возникшую тахиаритмию 2-мя возможными путями: пачкой импульсов (по 8-10) с частотой превышающей частоту тахикардии (один из импульсов проникает в циркулирующую электрическую петлю и обрывает ее), либо одиночным разрядом электрического тока высокого напряжения (рис.11, 12).
 рис.11.
рис.11.
 рис.12.
рис.12.
Показанием для выполнения ресинхронизирующей терапии является обязательное сочетание тяжелой ХСН с ЭКГ-картиной полной блокады левой ножки пучка Гиса. Чем выраженнее блокада, тем выше вероятность положительного клинического эффекта от ресинхронизирующей терапии. На рис.13 запечатлен момент включения ресинхронизирующей терапии: до ее включения регистрируется блокада левой ножки (ширина комплекса 150 мс), в момент включения - блокада исчезает (ширина комплекса 100 мс), что отражает появившийся синхронизм в сокращении правого и левого желудочка.

Имплантация современных кардиостимуляторов приводит к минимальным ограничениям в жизни больного. При сохранении насосной функции сердца пациент с кардиостимулятором может вести обычный образ жизни: дача, любые домашние дела, работа, занятия физкультурой, путешествия, вождение автомобиля и т.д. Те ограничения, которые существовали раннее (запрет на использование больными различных электронных приборов), были обусловлены использованием монополярных систем кардиостимуляции. В таком случае при контакте с источниками высокого напряжения развивалось явление интермагнитной интерференции, что приводило к некорректной работе кардиостимулятора. Моно полярная и биполярная конфигурация устройства определяет разность потенциалов между двумя полюсами электродов ; при моно полярной чувствительности вторым полюсом электрода является корпус кардиостимулятора . Поэтому при моно полярном варианте из-за большого межэлектродного расстояния, равного 30-50 см, ЭКС может воспринимать все сигналы, попадающие в эти пределы (сокращения скелетных мышц, электрическую активность других сердечных камер и т.д.), тогда как при биполярном варианте конфигурации анод и катод находятся на конце электрода (расстояние между ними: 1-2 см) - в таком случае посторонние электрические сигналы не воспринимаются.

В настоящее время используют биполярные системы стимуляции, которые практически исключают проявление интермагнитной интерференции, а сами ИПК исправно работают даже после наружной дефибрилляции. Ограничения сохраняются лишь на профессиональную деятельность, которая связана с постоянным контактированием с источниками высокого напряжения (электроподстанции, электрощитовые, электромонтажные работы, сварка, отбойный молоток). Единственным абсолютным противопоказанием для больных с кардиостимулятором является проведением магнитно-резонансной томографии и прямое прикладывание магнита к подшитому аппарату. Некоторые зарубежные производители кардиостимуляторов вводят в эксплуатацию ИПК, допускающие возможность проведения МРТ. Однако пока безопасность проведение данной диагностики не будет доказан в рандомизированном исследовании выполнение МРТ больным с кардиостимулятором останется под запретом. Основой нормальной жизни пациента с кардиостимулятором являются плановые проверки системы у специалиста программирующего ИПК. Эквивалентом таких проверок может стать регулярное (раз в 6-12 месяцев) Холтеровское мониторирование ЭКГ , позволяющее вовремя выявить неполадки в работе кардиостимулятора. Впрочем, визитов к аритмологу все равно не избежать, хотя бы для того чтобы знать примерный срок службы батарейки ИПК и время ее плановой замены.
Кардиостимуляция осуществляется в режиме "по требованию". При корректной программации аппарата приоритет отдается собственным сокращениям сердца.
Современная кардиостимуляция не мыслима без функция частотной адаптации ().
Залогом надежного функционирования ЭКС является регулярная (раз в 6-12 месяцев) оценка эффективности его работы с помощью суточного мониторирования ЭКГ ; она позволит подтвердить правильность выбора режима стимуляции и своевременно выявить .
Каждому пациенту с ИПК выдается на руки так называемый паспорт кардиостимулятора. Его можно сравнить с инструкцией к применению какого-нибудь электроприбора. В данном документе указывается вся важнейшая информация, касающаяся параметров работы устройства: начиная от локализации электродов, заканчивая тонкими электрофизиологическим параметрами кардиостимуляции. Казалось бы, что пациенту до этого: он доверился врачу, который все сделал как надо. Так собственно и считает абсолютное большинство больных. Впрочем, всегда находится небольшой процент субъектов с кардиостимуляторами из категории "хочу все знать"; либо связывающие свое плохое самочувствие с "некорректно настроенными параметрами стимуляции" (так они сами считают), что заставляет их проводить время в "поисках истины".
После плановой проверки кардиостимулятора хирургом-аритмологом больному на руки выдается краткое заключение, отражающее текущие параметры кардиостимуляции (что было - что изменено); по сути данное заключение является упрощенным эквивалентом паспорта кардиостимулятора. При утере последнего такие заключения являются единственным источником информации о текущих настройках кардиостимулятора. Вне зависимости от того, что у пациента есть на руках (паспорт или заключение после плановой проверки устройства), при изучении данной документации можно увидеть разнообразные русскоязычные или англоязычные (в зависимости от страны производителя кардиостимулятора) специфические термины или, того хуже, непонятную аббревиатуру. Что-то типа:
Разберем наиболее важные понятия.
Режим (Mode) - отражает базовые характеристики кардиостимулятора. Представлен в виде последовательности заглавных английских букв; как правило 3-4-х, например: например DDDR . Что под ними скрывается?
Первая буква означает, какая камера стимулируется (то есть, где находится стимулирующий электрод): в предсердии (А - atrium) , в желудочке (V - ventricle) или в обеих камерах (D - dual).
Вторая буква означает, информация об электрической активности какой камеры сердца передается в кардиостимулятор (функция детекции / распознавания / восприятия). Другими словами, какая камера детектируется стимулятором: предсердие (А - atrium) , желудочек (V - ventricle) или обе камеры (D - dual).
Третья буква означает, разновидность реакции кардиостимулятора на полученную информацию от детектирующего электрода: I - inhibited (запрещение), T - triggered (стимуляция), D - dual (двойной ответ), возможны сочетания запрещающей и стимулирующей реакции.
Четвертая буква, если есть, обозначает наличие функции частотной стимуляции сердца (R - Rate modulation ) - способность кардиостимулятора выдавать импульсацию не с фиксированной частотой, а согласно потребностям организма (разгонять частоту сердечных сокращений).
Пятая буква, если есть, обозначает наличие функции кардиовертера-дефибриллятора: P (Pase - антитахикардитическая стимуляция), S (shock - дефибрилляция, шок) или D (P+S).
Если говорить, о самом сейчас распространенном режиме кардиоc тимуляции DDDR , то анализируя данную аббревиатуру, мы можем сказать следующее: "В обеих камерах сердца находится стимулирующий электрод (D - dual , обе) - то есть стимулируются и предсердия и желудочки; детектируется (воспринимается) информация об электрической активности обеих (D - dual) камер сердца; в зависимости от полученной информации от детектирующих электродов, кардиостимулятор может запретить себе выдавать стимуляцию (и продолжить следить за электрической активностью сердца) или осуществить стимуляцию (D - dual , оба ответа); кардиостимулятор имеет функцию частотной адаптации (R )".
Для полноценного понимания написанного, рассмотрим еще один режим стимуляции, широко используемый при брадикардитической фибрилляции предсердий - VVI . Анализируя данную аббревиатуру, мы можем сказать следующее: "Стимулирующий электрод находится в желудочке (V - ventricle ); воспринимающий электрод находится в желудочке (V - ventricle ); если стимулятор улавливает собственное сокращение желудочков, он не выдает импульс (I - inhibited , запрещение), отдавая тем самым приоритет спонтанной (естественной) электрической активности желудочков".
Таким образом, кардиостимулятор может быть однокамерным (электрод в одной камере, например VVI ) или двухкамерным (в обеих камерах по электроду, например DDDR ).
Важная ремарка: в одной сердечной камере может быть только один электрод; в зависимости от режима этот электрод выполняет или стимуляцию, или детекцию, или и то, и другое.
Базовая частота стимуляции (Base Rate, Lower Rate, Basic Rate) - частота, с которой осуществляется стимуляция сердца при отсутствии собственных сокращений. Как правило, программируется на значение 55 или 60 ударов в минуту.
Во-вторых, от общего процента желудочковой стимуляции - чем чаще желудочки сокращаются от стимулятора, тем выше риск развития синдрома кардиостимулятора. Именно для этого используют различные алгоритмы уменьшающие общий процент навязанных сокращений или уменьшают базовую частоту стимуляции - все, чтобы сердце как можно чаще сокращалось естественным образом, а ЭКС срабатывал лишь в редких эпизодах на подстраховке (Demand ).
В третьих, если в работе стимулятора не используется алгоритм . Если его нет - риск развития синдрома кардиостимулятора крайне высок.
В четвертых, если запрограммирована длительная (300-350 мс).
В-пятых, от длительности кардиостимуляции: даже при абсолютно корректной настройке ЭКС (например, режим DDDR ) никто не даст гарантии, что с годами у пациента не разовьется синдром кардиостимулятора.
Манифестировавший пейсмекерный синдром фактически представляет собой симптомокомплекс сердечной недостаточности, вызванный длительной кардиостимуляцией. Его проявления: слабость, отеки ног, быстрая утомляемость, головокружения, лабильность АД, одышка при минимальной нагрузке, тенденция к низкому АД.
Имплантированный в камеры сердца электрод кардиостимулятора чужероден для среды, в которой оказался. При проведении электрода в правый желудочек он неизбежно соприкасается со створками трикуспидального клапана, и этот контакт сохраняется все время нахождения электрода в сердце. В месте соприкосновения створки клапана и электрода возникает асептическое воспаление, которое приводит к необратимой деформации створки и развитию недостаточности трикуспидального клапана. Однако выраженность электрод-индуцированной трикуспидальной недостаточности может быть абсолютно разной: от незначительной или умеренной (часто), до тяжелой (редко). Важно понимать, что изначально невозможно предугадать, насколько тяжелой будет недостаточность клапана при имплантированном электроде. Однозначно утверждать можно лишь одно: она (клапанная регургитация) будет у каждого пациента. К счастью, практический опыт показывает, что электрод-индуцированная трикуспидальная недостаточность редко достигает тяжелой степени и мало сказывается на гемодинамике. Если же все-таки она достигла тяжелой степени, то это будет сопровождаться характерными симптомами сердечной недостаточности (слабость, одышка, отеки ног). Любая степень электрод-индуцированной трикуспидальной недостаточности не является показанием для замены (реимплантации) электрода.

Имплантируемый электрокардиостимулятор
Электрокардиостимуля́тор (ЭКС ), или иску́сственный води́тель ри́тма (ИВР) – медицинский прибор, предназначенный для воздействия на ритм сердца . Основной задачей водителей ритма является поддержание или навязывание частоты сердечных сокращений пациенту, у которого или сердце бьётся недостаточно часто, или имеется электрофизиологическое разобщение между предсердиями и желудочками (атриовентрикулярная блокада). Также имеются специальные (диагностические) наружные кардиостимуляторы для проведения нагрузочных функциональных проб.
История создания электрокардиостимуляторов
Впервые способность импульсов электрического тока вызвать сокращения мышцы заметил итальянец Алессандро Вольта . Позднее российские физиологи Ю. М. Чаговец и Н. Е. Введенский изучили особенности воздействия электрического импульса на сердце и предположили возможность использования их для лечения некоторых заболеваний сердца. В году Hyman G. создал первый в мире наружный электрокардиостимулятор и применил его в клинике для лечения больного, страдающего редким пульсом и потерями сознания. Это сочетание известно как приступ Морганьи-Эдемса-Стокса (МЭС).
В году американские кардиохирурги Callaghan и Bigelow использовали кардиостимулятор для лечения больной после операции, так как у неё развилась полная поперечная блокада сердца с редким ритмом и приступами МЭС. Однако у данного прибора имелся большой недостаток - он находился вне тела пациента, и импульсы к сердцу проводились по проводам через кожу.
В году шведские ученые (в частности Руне Элмквист) создали имплантируемый, то есть полностью находящийся под кожей, кардиостимулятор. (Siemens-Elema). Первые стимуляторы были недолговечными: их срок службы составлял от 12 до 24 месяцев.
В России история кардиостимуляции ведет отсчет с года, когда академик А. Н. Бакулев обратился к ведущим конструкторам страны с предложением о разработке медицинских аппаратов. И тогда в конструкторском бюро точного машиностроения (КБТМ) - ведущем предприятии оборонной отрасли, возглавляемом А. Э. Нудельманом – начались первые разработки имплантируемых ЭКС (А. А. Рихтер, В. Е. Бельгов). В декабре 1961 года первый российский стимулятор, ЭКС-2 («Москит»), был имплантирован академиком А. Н. Бакулевым больной с полной атриовентрикулярной блокадой. ЭКС-2 был на вооружении врачей более 15 лет, спас жизнь тысячам больных и зарекомендовал себя как один из наиболее надежных и миниатюрных стимуляторов того периода в мире.
Показания к применению
- Синдром слабости синусового узла
Методики стимуляции
Наружная кардиостимуляция
Наружная кардиостимуляция может быть использована для первичной стабилизации больного, но она не исключает имплантацию постоянного кардиостимулятора. Методика заключается в размещении двух пластин стимулятора на поверхности грудной клетки. Один из них обычно располагается на верхней части грудины , второй – слева сзади практически на уровне последних ребер. При прохождении электрического разряда между двумя пластинами он вызывает сокращение всех мышц, расположенных на его пути, в том числе сердца и мышц грудной стенки.
Пациент с наружным стимулятором не может быть оставлен без присмотра на длительное время. Если пациент находится в сознании, применение этого вида стимуляции вызовет у него дискомфорт вследствие частого сокращения мышц грудной стенки. К тому же стимуляция мышц грудной стенки ещё не означает стимуляцию сердечной мышцы. В целом метод недостаточно надёжен, поэтому применяется редко.
Временная эндокардиальная стимуляция (ВЭКС)
Стимуляция производится через зонд-электрод, проведённый по центральному венозному катетеру в полость сердца. Операция установки зонда-электрода проводится в стерильных условиях, наилучшим вариантом является использование для этого одноразовых стерильных наборов, включающих собственно зонд-электрод и средства его доставки. Дистальный конец электрода устанавливается в правом предсердии или правом желудочке. Проксимальный конец снабжен двумя универсальными клеммами для подключения к любому пригодному наружному стимулятору.
Временная кардиостимуляция часто используется для спасения жизни пациента, в т.ч. как первый этап перед имплантацией постоянного водителя ритма. При определённых обстоятельствах (например в случае острого инфаркта миокарда с преходящими нарушениями ритма и проводимости или в случае временных нарушений ритма/проводимости вследствие передозировки медикаментов) пациент после осуществления временной стимуляции не будет переведён на постоянную.
Имплантация постоянного кардиостимулятора
Имплантация постоянного водителя ритма – это малое оперативное вмешательство, оно проводится в рентгеноперационной. Пациенту не осуществляется общий наркоз, производится только местное обезболивание в области операции. Операция включает несколько этапов: разрез кожи и подкожной клетчатки, выделение одной из вен (чаще всего – головной , она же v.cefalica ), проведение через вену одного или более электродов в камеры сердца под рентгеновским контролем, проверку параметров установленных электродов с помощью наружного прибора (определение порога стимуляции, чувствительности и др.), фиксацию электродов в вене, формирование в подкожной клетчатке ложа для корпуса кардиостимулятора, подключение стимулятора к электродам, ушивание раны.
Обычно корпус стимулятора располагают под подкожной жировой клетчаткой грудной клетки. В России принято имплантировать стимуляторы слева (правшам) или справа (левшам и в ряде других случаев – например при наличии рубцов кожи слева), хотя вопрос о размещении решается в каждом случае индивидуально. Наружная оболочка стимулятора крайне редко вызывает отторжение, т.к. её изготавливают из титана , или специального сплава, являющегося инертным для тела.
Чреспищеводная кардиостимуляция
Для диагностических целей иногда применяется также метод чреспищеводной электрокардиостимуляции (ЧПЭС), иначе называемый неинвазивным электрофизиологическим исследованием сердца. Эта методика применяется у пациентов с подозрением на нарушения функции синусового узла, у пациентов с преходящими нарушениями атривентрикулярной проводимости, пароксизмальными нарушениями ритма, подозрением на наличие дополнительных проводящих путей (ДПП) и иногда как замена нагрузочной велоэргометрической или тредмил-пробы.
Исследование проводится натощак. Пациент лежит на кушетке. Через нос (реже через рот) ему вводят в пищевод специальный двух- или трёхполюсный зонд-электрод, устанавливают этот зонд в пищеводе на уровне, где с пищеводом соприкасается левое предсердие. В этой позиции осуществляют стимуляцию импульсами напряжением как правило от 5 до 15 В, близость левого предсердия к пищеводу позволяет навязать таким образом ритм сердцу.
В качестве водителя ритма используются специальные наружные приборы-кардиостимуляторы, например ЧЭЭКСП.
Стимуляция проводится по разным методикам с разной целью. Приницпиально существует учащающая стимуляция (частоты близки к частотам собственного ритма), частая (от 140 до 300 имп/мин), сверхчастая (от 300 до 1000 имп/мин), а также программированная (в этом случае выдается не «сплошной ряд» стимулов, а их группы («пачки», «залпы», в англоязычной терминологии burst) с разной частотой, запрограммированные по специальному алгоритму).
Чреспищеводная стимуляция является безопасным методом диагностики, т.к. воздействие на сердце происходит кратковременно и мгновенно прекращается при выключении стимулятора. Стимуляция с частотами более 170 имп/мин производится в течение 1-2 сек., что также вполне безопасно.
Диагностическая эффективность ЧПЭС при различных заболеваниях различна. Поэтому исследование проводится только по строгим показаниям. В случаях, когда ЧПЭС не дает полной и/или исчерпывающей информации – пациенту приходится проводить инвазивное ЭФИ сердца, что существенно труднее и дороже, проводится в условиях рентгеноперационной и сопряжено с введением катетера-электрода в полость сердца.
Методом чреспищеводной электростимуляции иногда осуществляется и лечение: купирование пароксизмального трепетания предсердий (но не мерцательной аритмии) или некоторых видов наджелудочковых пароксизмальных тахикардий.
Основные функции кардиостимулятора
Кардиостимулятор представляет собой прибор в герметичном стальном корпусе небольшого размера. В корпусе располагается батарея и микропроцессорный блок. Все современные стимуляторы воспринимают собственную электрическую активность (ритм) сердца, и если возникает пауза, либо иное нарушение ритма/проводимости в течение определенного времени, прибор начинает генерировать импульсы для стимуляции миокарда. В противном случае – при наличии адекватного собственного ритма – кардиостимулятор импульсы не генерирует. Эта функция ранее называлась «по требованию» или «on demand».
Энергия импульсов измеряется в джоулях , однако на практике применяется шкала напряжения (в вольтах) для имплантируемых кардиостимуляторов и шкалы напряжения (в вольтах) или тока (в амперах) для наружных стимуляторов.
Существуют имплантируемые кардиостимуляторы с функцией частотной адаптации. Они снабжены сенсором , воспринимающим физическую активность пациента. Чаще всего сенсор – это акселерометр , датчик ускорений. Однако встречаются также сенсоры, определяющие физическую активность в соответствии с минутной вентиляцией легких или по изменению параметров электрокардиограммы (интервала QT) и некоторые другие. Информация о движении тела человека, полученная с сенсора, после обработки процессором стимулятора управляет частотой стимуляции, позволяя адаптировать её к потребностям пациента во время выполнения физической нагрузки.
Некоторые модели кардиостимуляторов могут отчасти предупреждать возникновение аритмий (фибрилляцию и трепетание предсердий, пароксизмальные наджелудочковые тахикардии и др.) за счет специальных режимов стимуляции, в т.ч. overdrive pacing (принудительного учащения ритма относительно собственного ритма пациента) и прочих. Но показано, что эффективность этой функции невелика, следовательно наличие кардиостимулятора в общем случае не гарантирует устранения аритмий.
Современные электрокардиостимуляторы могут накапливать и сохранять данные о работе сердца. В последующем, врач, с помощью специального компьютерного аппарата - программатора, может считать эти данные и проанализировать ритм сердца, его нарушения. Это помогает назначить адекватное медикаментозное лечение и подобрать адекватные параметры стимуляции. Проверка работы имплантированного кардиостимулятора с программатором должна производиться не реже 1 раза в 6 месяцев , иногда и чаще.
Система маркировки стимуляторов
Кардиостимуляторы бывают однокамерные (для стимуляции только желудочка или только предсердия), двухкамерные (для стимуляции и предсердия и желудочка) и трёхкамерные (для проведения стимуляции правого предсердия и обеих желудочков). Кроме того применяются имплантируемые кардиовертеры-дефибрилляторы.
В году была выработана система трёхбуквенных кодов для описания функций стимуляторов По разработчику код назван ICHD (Intersociety Commission on Heart Disease).
В последующем создание новых моделей ЭКС привело к появлению пятибуквенного кода ICHD и его трансформации затем в пятибуквенный код имплантируемых систем электрического воздействия на ритм сердца -- ЭКС, кардиовертеров и дефибрилляторов в соответствии с рекомендациями Британской группы по изучению электрокардиостимуляции и электрофизиологии (British Pacing and Electrophysiology Group – BREG) и Северо-Американского общества электрокардиостимуляции и электрофизиологии (North American Society of Pacing and Electrophysiology – NASPE). Окончательный действующий ныне код называется NASPE/BREG (NBG) .
В России традиционно применяется нечто вроде комбинированной кодировки: для режимов стимуляции, не имеющих частотной адаптации, применяется трехбуквенный код ICHD, а для режимов с частотной адаптацией – первые 4 буквы кода NASPE/BREG (NBG).
Согласно коду NBG :
Обозначения в данной таблице - это сокращения английских слов.А – atrium, V – ventricle, D – dual, I – inhibition, S – single (в позициях 1 и 2), T – triggering, R – rate-adaptive.
Например, согласно этой системе VAT будет означать: стимулятор в режиме детекции ритма предсердия и стимуляции желудочка в режиме биоуправления, без частотной адаптации.
Наиболее распространённые режимы стимуляции:VVI – однокамерная желудочковая стимуляция по требованию (по старой российской номенклатуре «R-запрещаемая стимуляция желудочка» ),VVIR AAI – однокамерная предсердная стимуляция по требованию (по старой российской номенклатуре «P-запрещаемая стимуляция предсердия» ),AAIR – то же с частотной адаптацией,DDD – двухкамерная предсердно-желудочковая биоуправляемая стимуляция,DDDR – то же с частотной адаптацией. Последовательная стимуляция предсердия и желудочка называется секвенциальной .
VOO/DOO – асинхронная стимуляция желудочка/асинхронная секвенциальная стимуляция (в клинической практике как постоянная не применяется, возникает в особых случаях работы стимулятора, например при магнитном тесте или при наличии внешних электромагнитных помех. Чреспищеводная кардиостимуляция чаще всего проводится в режиме AOO (формально это не противоречит стандартным обозначениям, хотя предсердие при эндокардиальной стимуляции имеется в виду правое, а при ЧПЭС – левое)).
Совершенно очевидно, что, например, стимулятор типа DDD принципиально возможно программно перевести в режим VVI или VAT. Таким образом, код NBG отражает и принципиальную способность данного кардиостимулятора и режим работы прибора в каждый момент времени. (Например: ИВР типа DDD, работающий в режиме AAI ). Двухкамерные стимуляторы зарубежных и некоторых отечественных производителей обладают кроме всего прочего функцией «переключения режимов» (switch mode – стандартное международное наименование). Так, например, при развитии у пациента с имплантированным ИВР в режиме DDD мерцательной аритмии, стимулятор переключается в режим DDIR и т.д. Это сделано для обеспечения безопасности пациента.
Ряд производителей ИВР расширяют данные правила кодирования для своих стимуляторов. Так например Sorin Group применяет для ИВР типа Symphony режим, обозначаемый как AAIsafeR (а также AAIsafeR–R ). Принципиально похожий режим фирма Medtronic для своих ИВР Versa и Adapta обозначает AAI<=>DDD и т.д..
Двухжелудочковая стимуляция (BVP, biventricular pacing)
При некоторых заболеваниях сердца возможна ситуация, когда предсердия, правый и левый желудочки сокращаются несинхронно. Такая асинхронная работа приводит к снижению производительности сердца как насоса и ведёт к развитию сердечной недостаточности, недостаточности кровообращения.
При данной методике (BVP) стимулирующие электроды помещаются в правое предсердие и к миокарду обоих желудочков. Один электрод располагается в правом предсердии, в правом желудочке электрод находится в его полости, а к левому желудочку он подводится через венозный синус.
Такой вид стимуляции называется также кардиоресинхронизирующей терапией (CRT).
Путём подбора параметров последовательной стимуляции предсердия и левого и правого желудочка в ряде случаев удаётся устранить диссинхронию и улучшить насосную функцию сердца. Как правило для подбора действительно адекватных параметров у таких приборов требуется не только перепрограммирование и наблюдение за пациентом, но и контроль одновременно эхокардиографии (с определением параметров сердечного выброса, в т.ч. VTI – интеграла объемной скорости кровотока).
В наше время могут быть применены и комбинированные устройства, обеспечивающие РСТ, функции ИКД, ну и конечно стимуляцию при брадиаритмиях. Однако стоимость подобных устройств до сих пор весьма велика, что сдерживает их применение.
Иммплантируемые кардиовертеры-дефибрилляторы (ИКД, ИКВД)
Остановка кровообращения у пациента может произойти не только при остановке водителя ритма сердца или развитии нарушений проведения (блокад), но и при фибрилляции желудочков или при желудочковой тахикардии.
Если человек по этой причине имеет высокий риск остановки кровообращения, ему имплантируют кардиовертер-дефибриллятор. Кроме функции стимуляции при брадисистолических нарушениях ритма он имеет функцию прерывания фибрилляции желудочков (а также трепетания желудочков, желудочковой тахикардии). С этой целью, после распознавания опасного состояния, кардиовертер-дефибриллятор наносит разряд от 12 до 35 Дж, что в большинстве случаев восстанавливает нормальный ритм, либо по крайней мере купирует жизнеугрожающие нарушения ритма. Если первый разряд был неэффективен, аппарат может повторить его до 6 раз. Кроме того современные ИКД помимо собственно разряда могут использовать различные схемы нанесения частой и залповой стимуляции, а также программированной стимуляции с различными параметрами. Это во многих случаях позволяет без нанесения разряда купировать жизнеугрожающие нарушения ритма. Тем самым кроме клинического эффекта достигается бо́льший комфорт для пациента (нет болезненного разряда) и экономия батареи прибора.
Опасность от кардиостимулятора
Кардиостимулятор – это высокотехнологичный прибор, реализующий множество современных технических и программных решений. В нём в т.ч. предусмотрено обеспечение многоступенчатой безопасности.
При появлении внешних помех в виде электромагнитных полей стимулятор переходит в асинхронный режим работы, т.е. перестает реагировать на эти помехи.
При развитии тахисистолических нарушений ритма двухкамерный стимулятор производит переключение режимов, чтобы обеспечить стимуляцию желудочка с безопасной частотой.
При разряде батареи стимулятор отключает часть встроенных функций, чтобы обеспечить жизнеспасающую стимуляцию (VVI) еще некоторое время – до замены батареи.
Кроме этого применяются иные механизмы обеспечения безопасности пациента.
В последние годы широко обсуждается в СМИ возможность целенаправленного причинения вреда пациенту с кардиостимулятором, обладающим возможностью дистанционного обмена с программатором. Принципиально такая возможность существует, что было убедительно показано. Однако следует учесть:
- бо́льшая часть ныне применяемых зарубежных и все отечественные кардиостимуляторы требуют для программирования близкого контакта с головкой программатора, т.е. не поддаются дистанционному воздействию вообще;
- потенциальный хакер должен иметь в своем распоряжении сведения о кодах обмена с кардиостимулятором, которые являются технологическим секретом фирмы-производителя. Попытка воздействовать на стимулятор без этих кодов приведет к тому, что он как при любых прочих недетерминируемых помехах перейдет в асинхронный режим и перестанет вообще воспринимать внешнюю информацию, следовательно не нанесёт вреда;
- сами возможности воздействия стимулятора на сердце конструктивно ограничены из соображений безопасности;
- хакер должен знать, что у данного пациента имеется стимулятор вообще, конкретной марки в частности, что данному пациенту по его состоянию здоровья вредны конкретные воздействия.
Таким образом, опасность подобного покушения на пациента представляется невысокой. Вероятно производители ИВР примут в дальнейшем меры по криптографической защите протоколов дистанционного обмена.
Отказ кардиостимулятора
Принципиально как и любой иной прибор, кардиостимулятор может отказать. Однако с учетом высокой надежности современной микропроцессорной техники и наличием у стимулятора дублированных систем безопасности – это происходит крайне редко, вероятность отказа составляет сотые доли процента. Вероятность отказа с принесением вреда пациенту еще меньше. Следует поинтересоваться у своего врача – как будет проявляться отказ конкретного стимулятора и что предпринимать в этом случае.
Однако само наличие в организме инородного тела – тем более электронного прибора – всё же требует от пациента соблюдения определенных мер безопасности.
Правила поведения для пациента с кардиостимулятором
Любой пациент с кардиостимулятором должен соблюдать некоторые ограничения .
- ЗАПРЕЩАЕТСЯ подвергаться воздействию мощных магнитных и электромагнитных полей, полей СВЧ, а также и непосредственному воздействию любых магнитов вблизи места имплантации.
- ЗАПРЕЩАЕТСЯ подвергаться воздействию электрического тока.
- ЗАПРЕЩАЕТСЯ выполнять магнитно-резонансную томографию (МРТ).
- ЗАПРЕЩАЕТСЯ использовать бо́льшую часть методов физиотерапии (прогревания, магнитотерапию и т.д.) и многие косметологические вмешательства, связанные с электрическим воздействием (конкретный перечень нужно уточнять у косметологов).
- ЗАПРЕЩАЕТСЯ проводить ультразвуковое исследование (УЗИ) с направлением луча на корпус стимулятора.
- ЗАПРЕЩАЕТСЯ наносить удары в грудь в область имплантации стимулятора, пытаться смещать аппарат под кожей.
- ЗАПРЕЩАЕТСЯ применять монополярную электрокоагуляцию при хирургических вмешательствах (в т.ч. эндоскопических), применение биполярной коагуляции должно быть максимально ограничено, в идеале - также не применять совсем.
Мобильный или иной беспроводной телефон желательно не подносить ближе 20–30 см к стимулятору, следует держать его в другой руке.Аудиоплеер лучше располагать также не вблизи от стимулятора.Можно пользоваться компьютером и подобными ему устройствами, в т.ч. портативными.Можно выполнять любые рентгеновские исследования, в т.ч. компьютерную томографию (КТ).Можно работать по дому или на участке, использовать инструмент, в т.ч. электроинструмент, при условии его исправности (чтобы не было поражения электрическим током).Следует ограничить применение перфораторов и электродрелей, а также газонокосилок. Косить вручную и колоть дрова следует с осторожностью, при возможности лучше отказаться от этого. Можно заниматься физкультурой и спортом, избегая контактно-травматических его видов и не допуская вышеупомянутого механического воздействия на область стимулятора. Нежелательны большие нагрузки на плечевой пояс. В первые 1–3 месяца после имплантации желательно ограничить движения рукой со стороны имплантации, избегая резких подъемов выше горизонтальной линии и резких отведений в сторону. Через 2 месяца указанные ограничения обычно снимаются. Разрешается заниматься плаванием.
Средства контроля в магазинах и аэропортах («рамки» ) в сущности испортить стимулятор не могут, однако желательно либо совсем не проходить их (для чего предъявить охране карточку владельца кардиостимулятора), либо сократить пребывание в зоне их действия до минимума.
Пациент с кардиостимулятором должен своевременно являться к врачу на проверки прибора с использованием программатора. Крайне желательно знать про себя: марку (название) имплантированного прибора, дату и повод имплантации.
Кардиостимулятор на ЭКГ
Работа кардиостимулятора существенно меняет картину электрокардиограммы (ЭКГ). При этом работающий стимулятор так изменяет форму комплексов на ЭКГ, что по ним становится невозможно судить о чем-либо. В частности, работа стимулятора может маскировать ишемические изменения и инфаркт миокарда. С другой стороны, т.к. современные стимуляторы работают «по требованию», отсутствие признаков работы стимулятора на электрокардиограмме ещё не означает его поломку. Хотя нередки случаи, когда средний медицинский персонал, а иногда и врачи при этом без должных оснований заявляют пациенту «у Вас не работает стимулятор», что сильно нервирует больного. Помимо этого, длительное наличие правожелудочковой стимуляции меняет и форму собственных комплексов ЭКГ, иногда имитируя ишемические изменения. Этот феномен носит название «синдром Шатерье» (правильнее – Чаттерджи по фамилии известного кардиолога Kanu Chatterjee).
Таким образом: интерпретация ЭКГ при наличии кардиостимулятора затруднена и требует специальной подготовки; при подозрении на острую патологию сердца (ишемию, инфаркт) их наличие/отсутствие следует подтверждать другими методами (чаще – лабораторным). Критерием правильной/неправильной работы стимулятора чаще является не обычная ЭКГ, а проверка с программатором и в ряде случаев суточное ЭКГ-мониторирование.
ЭКГ–заключение у пациента с кардиостимулятором
При описании ЭКГ у пациента с имплантированным ИВР указывается:
- наличие кардиостимулятора;
- режим его работы, если это известно или однозначно (следует учесть, что у двухкамерных стимуляторов возможны различные режимы работы, переход между которыми может осуществляться непрерывно, в т.ч. beat–to–beat, т.е. в каждом сокращении);
- описание собственных комплексов (при их наличии) по стандартам обычной ЭКГ (обязательно указывать с расшифровке, что интерпретация проводится по собственным комплексам);
- суждение о нарушении работы ИВР («нарушение функции детекции»,«нарушение функции стимуляции», «нарушение электронной схемы»), если на это есть основания.
При описании суточного ЭКГ у пациента с ИВР указывается:
- соотношение ритмов (сколько времени регистрировался какой ритм, в т.ч. ритм ИВР в режиме...);
- частоты ритма по обычным правилам описания холтеровского монитора;
- стандартная расшифровка данных монитора;
- сведения о выявленных нарушениях работы ИВР («нарушение функции детекции»,«нарушение функции стимуляции», «нарушение электронной схемы»), если на это есть основания, при этом все типы выявленных нарушений, а при небольшом количестве эпизодов – и все эпизоды должны быть иллюстрированы в заключении распечаткой фрагментов ЭКГ в описываемый момент времени. В случае отсутствия признаков нарушения функции ИВР допустима запись «признаков нарушения функции ИВР не выявлено».
Следует учесть, что при анализе работы современных ИВР целый ряд функций (гистерезис, псевдо-Венкебах, переключение режимов и прочие ответы на тахикардию, MVP и т.д.) могут имитировать неправильную работу стимулятора. Причем не существует способов отличить правильную работу от неправильной по ЭКГ. Врач функциональной диагностики, если он не имеет специальной подготовки по программированнию стимуляторов и не имеет в своём распоряжении исчерпывающих данных о запрограммированных режимах данного конкретного ИВР у данного пациента, не вправе выносить окончательные суждения об адекватности работы ИВР (кроме случаев явного нарушения функций прибора). В сомнительных случаях следует направлять пациентов на консультации по месту программирования/проверки ИВР.
В главе рассматриваются актуальные проблемы электрокардиотерапии сердечной недостаточности (установка кардиоресинхронизирующих устройств) в том числе у больных, относящихся к категории высокого риска внезапной сердечной смерти (использование электрокардиостимуляторов, кардиовертеров-дефибрилляторов). Обсуждаются этиология, патогенез, классификация, клинические проявления, возможности методов клинической, инструментальной и интервенционной диагностики, показания и противопоказания к электрокардиотерапии.
Ключевые слова: электрокардиостимуляция, дисфункция синусового узла, блокады сердца, кардиовертеры-дефибрилляторы, внезапная сердечная смерть, сердечный арест, желудочковая тахикардия, фибрилляция желудочков, сердечная недостаточность, желудочковая десинхронизация, кардиоресинхронизирующие устройства.
постоянная электрокардиостимуляция
Имплантация электрокардиостимуляторов
Постоянная электрокардиостимуляция реализуется путем имплантации системы электрокардиостимуляции, состоящей из электрокардиостимулятора (ЭКС) и электродов. Как правило, оперативное вмешательство выполняется с использованием сочетанной анестезии (местная анестезия и парентеральные седативные средства). Перед операцией с помощью программатора оценивают состояние батареи электрокардиостимулятора. Для имплантации электродов в большинстве случаев используется эндокардиальная методика. Электроды под флюороскопическим контролем устанавливают и фиксируют в правом предсердии и/или правом желудочке, с помощью наружного стимулятора проводится их тестирование (оцениваются импедансы, пороги стимуляции и амплитуда спонтанных биоэлектрических потенциалов). Ложе аппарата ЭКС формируется в подключичной области подкожно или субфасциально. Для профилактики инфекционных осложнений внутривенно назначают антибиотики.
Единый номенклатурный код
В настоящее время в международной практике для обозначения имплантируемых ЭКС и кардиовертеров-дефибрилляторов используется пятибуквенный номенклатурный код, который был разработан рабочей группой Североамериканского общества по электрокардиостимуляции и электрофизиологии (NASPE) и Британской группой по электрокардиостимуляции и электрофизиологии (BPEG) (см. табл. 2.1).
Буква в первой позиции кода обозначает камеру сердца, к которой поступает стимулирующий импульс. Вторая буква указывает на камеру сердца, из которой электрокардиостимулятором воспринимается спонтанный биоэлектрический сигнал. Буква в третьей позиции кода иллюстрирует режим, в котором система стимуляции
Таблица 2.1
Единый код ЭКС номенклатура NBG NASPE/BPEG (1987 г.)
отвечает на спонтанную электрическую активность сердца (I - стимуляция запрещается спонтанным сигналом из сердца, т.е. если есть спонтанная электрическая активность, то устройство не работает; Т - стимуляция запускается спонтанным сигналом из сердца, т.е. спонтанная электрическая активность предсердий запускает P-синхронизированную стимуляцию желудочков при двухкамерной ЭКС). Четвертая позиция кода характеризует возможности наружного (неинвазивного) программирования параметров стимуляции, а также наличие в системе ЭКС частотно-адаптивной функции. Буква в пятой позиции свидетельствует о наличии в системе ЭКС функции антитахикардитической стимуляции, включая кардиоверсию или дефибрилляцию.
В октябре 2001 г. рабочими группами NASPE и BPEG была предложена обновленная версия пятибуквенного номенклатурного кода для антибрадикардитических устройств, приведенного в табл. 2.2.
Как правило, для обозначения вида и режима электрокардиостимуляции используются первые три буквы кода (например: VVI, AAI, DDD), а буква R (IV позиция) используется для обозначения программируемых ЭКС с функцией частотной адаптации сердечного
ритма (например, VVIR, AAIR, DDDR).
Под частотной адаптацией или модуляцией следует понимать способность устройства увеличивать или уменьшать частоту стимуляции в пределах запрограммированных величин при активации сенсора нагрузок во время нарастания или прекращения физической активности, изменения психо-эмоционального статуса пациента.
Режимы постоянной электрокардиостимуляции
VVI - однокамерная желудочковая стимуляция в режиме «по требованию». Под данным режимом стимуляции понимают однокамерную "demand"-стимуляцию желудочков, которая осуществляется при снижении частоты спонтанного ритма сердца ниже установленного значения фиксированной частоты стимуляции и прекращается в случае превышения спонтанным ритмом сердца установленных частотных границ (I - ингибирующий механизм управления работы ЭКС). На рис. 2.1 приведен фрагмент ЭКГ, иллюстрирующий элек-
Таблица 2.2
Обновленный единый код ЭКС - номенклатура NBG - NASPE/BPEG (2001)

 Рис. 2.1.
Фрагмент
ЭКГ, иллюстрирующий однокамерную желудочковую стимуляцию «по
требованию» (VVI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Рис. 2.1.
Фрагмент
ЭКГ, иллюстрирующий однокамерную желудочковую стимуляцию «по
требованию» (VVI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. V-V-интервал - интервал между двумя последовательными желудочковыми стимулирующими импульсами - интервал желудочковой стимуляции (например, при базовой частоте стимуляции 60 имп/мин V-V-интервал равен 1000 мс); V-R-интервал - интервал между стимулирующим импульсом и последующим спонтанным сокращением желудочков сердца (при базовой частоте стимуляции 60 имп/мин V-R-интервал менее 1000 мс); R-V-интервал - интервал между спонтанным сокращением желудочков сердца и последующим стимулирующим импульсом в случае снижения частоты спонтанных сокращений желудочков ниже базовой частоты стимуляции (при базовой частоте стимуляции 60 имп/мин R-V-интервал равен 1000 мс)
трокардиостимуляцию в режиме VVI-60 имп/мин (базовая частота стимуляции).
Базовая частота стимуляции (нижняя граница частоты стимуляции) - частота, с которой осуществляется стимуляция желудочков или предсердий в отсутствие спонтанных сокращений (спонтанного ритма). Как показано на рис. 2.1, при снижении спонтанной частоты желудочковых сокращений менее 60 уд/мин (R-R интервал более 1000 мс) начинает осуществляться однокамерная стимуляция желудочков с частотой 60 имп/мин (V-V интервал 1000 мс). В том случае, если после нанесенного импульса в течение 1000 мс происходит детекция спонтанного желудочкового сокращения,
работа кардиостимулятора ингибируется (ингибирующий механизм управления работы ЭКС), и пациент находится на спонтанном сердечном ритме (при этом ЧСС более 60 уд/мин). Если после спонтанного сокращения желудочков в течение 1000 мс не происходит детекция очередного спонтанного комплекса QRS, возобновляется стимуляция желудочков с частотой 60 имп/мин. Необходимо отметить, что интервалы V-V и R-V равны и превышают интервал V-R (см. рис. 2.1).
Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом желудочке сердца. Недостатками данного вида электрокардиотерапии является то, что в ходе стимуляции нарушается адекватная предсердно-желудочковая синхронизация, что и обусловливает клинические признаки хронотропной недостаточности. По мнению большинства авторов, это является основным механизмом развития синдрома электрокардиостимулятора.
AAI - однокамерная предсердная стимуляция в режиме «по требованию» (рис. 2.2). Под данным режимом стимуляции понимают однокамерную «demand» стимуляцию предсердий, которая осуществляется при снижении частоты спонтанного предсердного ритма ниже установленного значения фиксированной частоты стимуляции и прекращается в случае превышения спонтанным ритмом сердца установленных частотных границ (I - ингибирующий механизм управления работы ЭКС).
При снижении частоты спонтанного предсердного ритма (рис. 2.2) ниже базовой частоты стимуляции (P-P-интервал больше запрограммированного интервала стимуляции (A-A-интервал), при базовой частоте стимуляции 60 имп/мин A-A-интервал равен 1000 мс) осуществляется однокамерная стимуляция предсердий с базовой частотой. В ситуации, когда после нанесенного на предсердия стимулирующего импульса в течение интервала стимуляции регистрируется спонтанное сокращение предсердий, работа кардиостимулятора ингибируется, и пациент находится на спонтанном синусовом ритме (при этом ЧСС превышает базовую частоту стимуляции). Если после спонтанного предсердного сокращения в течение интервала стимуляции не происходит детекция очередной спонтанной Р-волны, возобновляется предсердная стимуляция с фиксированной частотой. Необходимо отметить, что интервалы A-A и P-A равны и превышают интервал A-P (рис. 2.2).
 Рис. 2.2.
Фрагмент
ЭКГ, иллюстрирующий однокамерную предсердную стимуляцию «по требованию»
(AAI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Рис. 2.2.
Фрагмент
ЭКГ, иллюстрирующий однокамерную предсердную стимуляцию «по требованию»
(AAI-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. A-A-интервал - интервал между двумя последовательными предсердными стимулирующими импульсами - интервал предсердной стимуляции (например, при базовой частоте стимуляции 60 имп/мин A-A-интервал равен 1000 мс); A-P-интервал - интервал между стимулирующим импульсом и последующим спонтанным сокращением предсердий сердца (при базовой частоте стимуляции 60 имп/мин A-P-интервал менее 1000 мс); P-A-интервал - интервал между спонтанным сокращением предсердий сердца и последующим стимулирующим импульсом в случае снижения частоты спонтанных сокращений предсердий ниже базовой частоты стимуляции (при базовой частоте стимуляции 60 имп/мин P-A-интервал равен 1000 мс)
Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом предсердии сердца. При данном виде электрокардиотерапии сохраняется адекватная предсердно-желудочковая синхронизация, что позволяет определить ее как физиологическую. Недостатками AAI-ЭКС является отсутствие возможности частотной адаптации сердечного ритма у пациентов с хронотропной недостаточностью, так как нет функции частотной модуляции (R в четвертой позиции кода), а также невозможность использовать данный вид ЭКС у пациентов с нарушением атриовентрикулярной проводимости.
VVIR - однокамерная желудочковая частотно-адаптивная стимуляция. При данном виде стимуляции осуществляется однокамерная частотно-адаптивная стимуляция желудочков с ингибирующим механизмом управления работы ЭКС. Ингибирующий механизм управления подразумевает отсутствие (прекращение) стимуляции
при адекватной электрической активности сердца, сенсируемой устройством в указанной камере сердца (V - желудочек, т.е. R-запре- щающая стимуляция желудочков, где R - зубец комплекса QRS, не путать с R - функция частотной модуляции). Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом желудочке сердца. Данный вид электрокардиотерапии, так же как и в VVI-ЭКС, приводит к нарушению адекватной предсердно-желудочковой синхронизации.
AAIR - однокамерная предсердная частотно-адаптивная стимуляция. При данном виде стимуляции осуществляется однокамерная частотно-адаптивная стимуляция предсердий с ингибирующим механизмом управления работы ЭКС. Ингибирующий механизм управления подразумевает отсутствие (прекращение) стимуляции при адекватной электрической активности сердца, сенсируемой устройством в указанной камере сердца (А - предсердие, т.е. P-запрещающая стимуляция предсердий, где Р - зубец, иллюстрирующий электрическую активацию предсердий). Точка приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположена в правом предсердии сердца (невозможно использовать у пациентов с нарушениями АВ-проводимости). При данном виде электрокардиотерапии сохраняется адекватная предсердно-желудочковая синхронизация и имеется возможность частотной адаптации (модуляция) ритма сердца у пациентов с признаками хронотропной недостаточности.
VDD - однокамерная Р-синхронизированная стимуляция, при которой осуществляется стимуляция желудочков с сохранением адекватной предсердно-желудочковой синхронизации. При данном виде ЭКС используется как ингибирующий (R-запрещающая стимуляция желудочков, где R - зубец комплекса QRS, не путать с R - функция частотной модуляции), так и триггерный механизмы управления работы электрокардиостимулятора. Триггерный механизм управления подразумевает запуск стимуляции желудочков в ответ на адекватную электрическую активность сердца, сенсируемую в предсердиях (P-индуцированная стимуляция желудочков, где Р - зубец, иллюстрирующий электрическую активацию предсердий).
На рис. 2.3 приведен фрагмент ЭКГ, иллюстрирующий электрокардиостимуляцию в режиме VDD с базовой частотой стимуляции 60 имп/мин. Необходимым условием эффективной стимуляции в режиме VDD является превышение частоты спонтанного предсер-
 Рис. 2.3.
Фрагмент ЭКГ, иллюстрирующий однокамерную предсердно-синхронизированную стимуляцию желудочков (VDD-стимуляция). Примечание.
P
- спонтанное сокращение предсердий (спонтанная P-волна); AV -
предсердно-желудочковая (атриовентрикулярная) задержка; V -
стимулирующий импульс, нанесенный на желудочки (синхронизированный со
спонтанной P-волной)
Рис. 2.3.
Фрагмент ЭКГ, иллюстрирующий однокамерную предсердно-синхронизированную стимуляцию желудочков (VDD-стимуляция). Примечание.
P
- спонтанное сокращение предсердий (спонтанная P-волна); AV -
предсердно-желудочковая (атриовентрикулярная) задержка; V -
стимулирующий импульс, нанесенный на желудочки (синхронизированный со
спонтанной P-волной)
дного ритма базовой частоты стимуляции. После восприятия спонтанного предсердного сигнала запускается интервал атриовентрикулярной (АВ) задержки. Атриовентрикулярная (АВ) задержка - это интервал, который начинается от предсердного события (искусственно вызванного или спонтанного) и заканчивается нанесением стимула на желудочек при условии того, что в этот временной период не будет воспринято спонтанное желудочковое сокращение. В большинстве случаев значение АВ-задержки устанавливается в пределах от 150 до 180 мс. Таким образом, если за период АВ-задержки не происходит спонтанного сокращения желудочков, осуществляется P-синхронизированная стимуляция желудочков. Адекватная предсердно-желудочковая синхронизация будет сохраняться до момента достижения спонтанным ритмом предсердий частоты, равной установленному значению максимальной частоты синхронизации. Максимальная частота синхронизации (верхняя граница частоты стимуляции) - частота, до достижения которой синхронизированная со спонтанной предсердной активностью стимуляция желудочков осуществляется в соотношении 1:1, а при превышении ее начинается пейсмейкерная периодика Венкебаха.
При VDD-стимуляции точка приложения ЭКС расположена в правом желудочке сердца, а точки детекции спонтанных биоэлектрических сигналов - в правом предсердии и правом желудочке.
Существенным недостатком данного вида ЭКС является то, что при снижении частоты спонтанного предсердного ритма ниже установленных значений базовой частоты стимуляции нарушается предсердно-желудочковая синхронизация (режим VDD переходит в режим VVI), так как отсутствует возможность стимуляции предсердий. Данный вид постоянной электрокардиотерапии не применим у пациентов с признаками хронотропной недостаточности синусового узла.
DDD - двухкамерная электрокардиостимуляция. Данный вид стимуляции позволяет сохранять адекватную предсердно-желудочковую синхронизацию постоянно, так как при снижении частоты спонтанного предсердного ритма ниже установленных значений минимальной (базовой) частоты стимуляции осуществляется последовательная стимуляция как предсердий, так и желудочков. В ситуации, когда частота спонтанного предсердного ритма превышает минимальную частоту стимуляции, осуществляется однокамерная Р-синхронизированная (т.е. предсердно-синхронизированная) стимуляция желудочков (VDD-ЭКС).
При DDD-ЭКС используется как ингибирующий (P- и R-запре- щающая стимуляция, где R - зубец комплекса QRS, не путать с R - функцией частотной модуляции, а Р - зубец, иллюстрирующий электрическую активацию предсердий), так и триггерный (P-инду- цированная стимуляция желудочков, где Р - зубец, иллюстрирующий электрическую активацию предсердий) механизмы управления работы электрокардиостимулятора. Если частота спонтанного предсердного ритма ниже установленного значения базовой частоты стимуляции, наносится стимулирующий импульс на предсердия. В том случае, если за период запрограммированной АВ-задержки не происходит спонтанного сокращения, стимулятором наносится импульс на желудочки (рис. 2.4).
При DDD-ЭКС точки приложения стимуляции и детекции спонтанных биоэлектрических сигналов расположены в двух камерах сердца (в правом предсердии и правом желудочке). Недостатком данного вида ЭКС является отсутствие возможности частотной адаптации сердечного ритма у пациентов с признаками хронотропной недостаточности.
В зависимости от частоты спонтанного предсердного ритма и состояния атриовентрикулярной проводимости возможны несколько вариантов двухкамерной DDD-стимуляции.

Рис. 2.4. Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция) с базовой частотой стимуляции 60 имп/мин.
Примечание. A - стимулирующий импульс, нанесенный на предсердия; AV - предсердно-желудочковая (атриовентрикулярная) задержка; V - стимулирующий импульс, нанесенный на желудочки; A-A-интервал - интервал между двумя последовательными предсердными стимулирующими импульсами - интервал предсердной стимуляции (при базовой частоте стимуляции 60 имп/мин A-A интервал равен 1000 мс); V-V-интер- вал - интервал между двумя последовательными желудочковыми стимулирующими импульсами - интервал желудочковой стимуляции (при базовой частоте стимуляции 60 имп/мин V-V интервал равен 1000 мс); V-A-интервал - интервал между желудочковым импульсом и последующим стимулирующим импульсом на предсердия (V-A равен V-V (A-A) минус AV-задержка))
При низкой частоте спонтанного предсердного ритма (ниже базовой частоты стимуляции) и нарушенном атриовентрикулярном проведении будет осуществляться двухкамерная «секвенциальная» электрокардиостимуляция с установленной базовой частотой (рис. 2.5).
В ситуации, когда частота спонтанного предсердного ритма ниже базовой частоты стимуляции, а АВ-проводимость не нарушена (т.е. в период установленной атриовентрикулярной задержки происходят спонтанные желудочковые сокращения), осуществляется предсердная стимуляция с установленной базовой частотой (рис. 2.6).
При сохраненной адекватной спонтанной активности предсердий (частота предсердного ритма превышает базовую частоту сти-
 Рис. 2.5.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция).
Рис. 2.5.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (DDD-стимуляция).
Примечание. A - стимулирующий импульс, нанесенный на предсердия; V - стимулирующий импульс, нанесенный на желудочки
 Рис. 2.6.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию при сохраненной нормальной АВ-проводимости (AAI-сти- муляция).
Рис. 2.6.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию при сохраненной нормальной АВ-проводимости (AAI-сти- муляция).
Примечание. A - стимулирующий импульс, нанесенный на предсердия
муляции), но в условиях нарушенной АВ-проводимости (за период установленной АВ-задержки не происходит спонтанных сокращений желудочков), будет реализована предсердно-синхронизированная стимуляция желудочков в режиме VDD (рис. 2.7). Адекватная предсердно-желудочковая синхронизация будет сохраняться до момента достижения спонтанным ритмом предсердий частоты, равной установленному значению максимальной частоты синхронизации.
Если имеются эпизоды, когда частота предсердного ритма сердца превышает базовую частоту стимуляции и нет признаков нарушения атриовентрикулярной проводимости, будет происходить полное ингибирование работы электрокардиостимулятора.
DDDR - двухкамерная частотно-адаптивная электрокардиостимуляция. Данный вид постоянной электрокардиостимуляции является наиболее современным и полностью устраняет недостатки вышеописанных режимов ЭКС.
 Рис. 2.7.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (VDD-стимуляция)
Рис. 2.7.
Фрагмент ЭКГ, иллюстрирующий двухкамерную электрокардиостимуляцию (VDD-стимуляция)
Блокады сердца Определение
Под блокадами сердца понимают полные или частичные нарушения проведения импульсов, возникающие на различном уровне проводящей системы сердца вследствие изменений функционального или органического характера (см. табл. 2.3).
Общая классификация
По локализации:
1. Синоатриальные блокады.
2. Внутри- и межпредсердные блокады.
3. Атриовентрикулярные блокады.
4. Фасцикулярные блокады. По степени выраженности: Блокада I степени (неполная). Блокада II степени (неполная). Блокада III степени (полная). По стойкости: Преходящая. Перемежающаяся. Постоянная.
Латентная.
Дисфункция синусового узла Определение
Дисфункция синусового узла - это гетерогенный клинический синдром различной этиологии, связанный с нарушением хронотропной функции структурных компонентов, составляющих зону синоаурикулярного узла.
Классификация
Клинические формы дисфункции синусового узла (М.С. Кушаковский, 1992):
Синдром слабости синусового узла (СССУ) - дисфункции синусового узла органической природы.
Регуляторные (вагусные) дисфункции синусового узла.
Лекарственные (токсические) дисфункции синусового узла. Электрокардиографические эквиваленты СССУ:
1. Синусовая брадикардия с частотой менее 40 уд/мин в состоянии покоя.
2. Синус-арест (остановка синусового узла).
Критерии определения минимальной продолжительности синусовой паузы, которую можно было бы классифицировать как эпизод синус-ареста, не определены. Однако возникновение пауз более 3 с позволяет с большой долей вероятности предположить остановку синусового узла.
3. Синоатриальная (СА) блокада по степени выраженности подразделяется на:
СА-блокаду I степени - характеризуется замедлением проведения импульсов от синоатриального узла к предсердиям, что не находит отражения на ЭКГ;
СА-блокаду II степени тип I (с периодикой Самойлова-Венкебаха) - при этом наблюдается постепенное укорочение интервалов Р-Р, предшествующих выпадению зубца Р;
СА-блокаду II степени тип II - на ЭКГ отмечается выпадение одного или нескольких зубцов Р, что приводит к возникновению пауз, кратных двум или нескольким интервалам Р-Р;
СА-блокаду III степени - ни один импульс из синоатриального узла не проводится на предсердия.
4. Чередование замедленного синусового ритма или медленного замещающего ритма с пароксизмами тахикардии, как правило, суправентрикулярного происхождения (синдром брадикардии-тахикардии).
Наиболее часто наблюдаемым пароксизмальным суправентрикулярным нарушением ритма сердца у пациентов с СССУ является фибрилляция предсердий (синдром Шорта). Однако также возможна верификация трепетания предсердий, ускоренного ритма из АВсоединения, реципрокной АВ-узловой тахикардии. В редких случаях может наблюдаться и желудочковая тахикардия.
5. Замедленное восстановление функции синусового узла (появление синусовых пауз) после электрической или медикаментозной кардиоверсии.
Атриовентрикулярные блокады Определение
Атриовентрикулярная блокада - замедление или полное нарушение проведения импульсов от предсердий к желудочкам. Классификация По степени выраженности:
1. АВ-блокада I степени - определяется как аномальное удлинение интервала P-Q (более 210-220 мс).
2. АВ-блокада II степени тип Мобиц I (с периодикой СамойловаВенкебаха) - для нее характерно прогрессивное удлинение интервала P-Q до возникновения блокирования проведения. Максимальный прирост интервала P-Q отмечается между первым и вторым сокращением в цикле Венкебаха. Интервал P-Q имеет наибольшую продолжительность в сокращении, предшествующем блокированию АВ-проведения, и наименьшую - после выпавшего комплекса QRS. В большинстве случаев данный вид блокады ассоциируется с узким комплексом QRS.
3. АВ-блокада II степени тип Мобиц II - интервалы P-Q до и после блокирования проведения имеют фиксированную продолжительность. Для данного типа АВ-блокады в большинстве случаев характерен широкий комплекс QRS. При АВ-блокаде II степени с проведением 2:1 она не может быть классифицирована на первый или второй тип, однако о типе блокады можно косвенно судить по ширине комплекса QRS.
4. АВ-блокада III степени - АВ-проведение отсутствует полностью, на ЭКГ признаки полной АВ-диссоциации.
По анатомическому уровню нарушения проводимости:
супрагисиальные АВ-блокады;
Интрагисиальные АВ-блокады;
Инфрагисиальные АВ-блокады.
Фасцикулярные блокады Определение
Фасцикулярная блокада - нарушение проведения импульсов в системе Гиса-Пуркинье.
Классификация
I. Монофасцикулярные блокады:
1. Блокада правой ножки пучка Гиса.
2. Блокада передневерхнего разветвления левой ножки пучка Гиса.
3. Блокада задненижнего разветвления левой ножки пучка Гиса.
II. Бифасцикулярные блокады:
1. Односторонняя - блокада левой ножки пучка Гиса.
2. Двухсторонняя:
а) правой ножки и передневерхнего разветвления левой ножки пучка Гиса.
б) правой ножки и задненижнего разветвления левой ножки пучка Гиса.
III. Трифасцикулярные блокады - сочетание АВ-блокады с любой из вышеперечисленных бифасцикулярных блокад.
IV. Периферические блокады (системы Гиса-Пуркинье).
Патофизиология блокад сердца
Дисфункция синусового узла и АВ-блокады характеризуются клиническими проявлениями хронотропной некомпетентности вследствие задержки или отсутствия проведения импульсов от синусового узла к предсердиям или от предсердий к желудочкам. Клиническая симптоматика обусловлена гипоперфузией жизненно важных органов, в особенности головного мозга и сердца, как результат синдрома малого сердечного выброса вследствие брадисистолии (см. табл. 2.4).
Нарушение меж- и внутрижелудочкового проведения импульсов приводит к десинхронизации работы правого и левого желудочков, что способствует прогрессии сердечной недостаточности, повышает риск развития пароксизмальных желудочковых нарушений ритма сердца.
Таблица 2.3
Этиология блокад сердца

 Таблица 2.4
Таблица 2.4
Пациенты с СССУ могут иметь клиническую симптоматику, обусловленную тахикардией, брадикардией или сочетанием данных форм нарушений сердечного ритма. Для определения показаний к постоянной электрокардиотерапии у данной категории пациентов необходимо выявить четкую связь клинической симптоматики с аритмией. Определение этой связи может быть затруднено в связи с преходящим характером нарушений ритма сердца и проводимости.
Клинические проявления при нарушении атриовентрикулярного проведения аналогичны симптомам при СССУ. Наиболее характерными являются жалобы на общую слабость, быструю утомляемость,
наличие пре- и синкопальных состояний, а также на развернутые приступы Морганьи-Адамса-Стокса (см. табл. 2.4).
У пациентов с биили трифасцикулярными блокадами часто отмечаются слабость, головокружение, снижение толерантности к физическим нагрузкам, синкопальные состояния. Основными причинами синкопальных состояний у данных пациентов могут быть преходящие нарушения атриовентрикулярной проводимости высокой степени, пароксизмальные желудочковые нарушения ритма сердца.
при синдроме слабости синусового узла (ACC/AHA/NASPE, 2002)
Класс I:
1. Дисфункция синусового узла с документированной симптомной синусовой брадикардией, включающей частые паузы, обуславливающие симптомы. У некоторых пациентов брадикардия является ятрогенной и возникает вследствие длительной медикаментозной терапии и/или ее передозировки.
2. Симптомная хронотропная недостаточность. Класс IIa:
1. Дисфункция синусового узла, возникающая спонтанно или как результат необходимой медикаментозной терапии с ЧСС менее 40 в минуту, когда четкая связь симптомов с брадикардией не документирована.
2. Синкопе неясного генеза со значимыми нарушениями функции синусового узла, выявленными или спровоцированными при электрофизиологическом исследовании.
Класс IIb:
1. Постоянная ЧСС при пробуждении менее 40 в минуту у пациентов с незначительной симптоматикой.
Класс III:
1. Дисфункция синусового узла у асимптомных пациентов, включая тех, у кого синусовая брадикардия (ЧСС менее 40 в минуту) является следствием длительной медикаментозной терапии.
2. Дисфункция синусового узла у пациентов с симптомами, похожими на брадикардитические, когда четко документировано отсутствие их связи с редким ритмом.
3. Дисфункция синусового узла с симптомной брадикардией в результате неадекватной медикаментозной терапии.
На наш взгляд, заслуживают внимания показания к постоянной электрокардиотерапии пациентов с синдромом слабости синусового узла, разработанные Д.Ф. Егоровым с соавт. (1995).
Клинико-электрофизиологические показания:
1) наличие приступов Морганьи-Адамса-Стокса на фоне брадиаритмии либо при купировании пароксизмов наджелудочковой тахикардии;
2) прогрессирующая недостаточность кровообращения на фоне брадиаритмии;
3) отсутствие эффекта или невозможность проведения медикаментозной терапии СССУ при наличии клинических проявлений брадиаритмии;
4) спонтанная асистолия по данным мониторирования ЭКГ длительностью 2000-3000 мс и более;
5) остановка или отказ синусового узла;
6) синоатриальная блокада степени с периодами асистолии более 2000 мс;
7) периодическое урежение числа сокращений желудочков менее 40 уд./мин, особенно в ночные часы.
Электрофизиологические показания:
Время восстановления функции синусового узла (ВВФСУ) - 3500 мс и более;
Коррегированное время восстановления функции синусового
узла (КВВФСУ) - 2300 мс и более;
Время истинной асистолии после стимуляции предсердий - 3000 мс и более;
Время синоатриального проведения (ВСАП) более 300 мс при наличии:
Признаков «вторичных» пауз во время ЭФИ;
- «парадоксальной» реакции на введение атропина во время
Признаков синоатриальной блокады на ЭКГ;
Отрицательная проба с атропином (прирост ЧСС менее 30% от исходной, уменьшение ВВФСУ менее чем на 30% от исходного).
Необходимо также добавить, что проведение постоянной электрокардиостимуляции абсолютно показано пациентам с постоянной формой фибрилляции предсердий с редким проведением на желудочки, симптоматичной брадикардией и клиническими проявлениями сердечной недостаточности. Напротив, имплантация ЭКС не пока-
зана при отсутствии клинической симптоматики на фоне брадиаритмии при фибрилляции предсердий (с ЧСС менее 40 в 1 минуту), даже если длительность отдельных интервалов R-R превышает 1500 мс.
у взрослых (ACC/AHa/nASPE, 2002)
Класс I:
1. АВ-блокада III степени и далеко зашедшая АВ-блокада II степени на любом анатомическом уровне, связанные с любым из следующих условий:
1) симптомная брадикардия (включая сердечную недостаточность) предположительно вследствие АВ-блокады;
2) аритмия или другие медицинские обстоятельства, требующие назначения лекарственных препаратов, вызывающих симптомную брадикардию;
3) документированные периоды асистолии равные 3,0 сек или более, а также любой выскальзывающий ритм менее 40 уд/мин при пробуждении, у асимптомных пациентов;
4) состояние после катетерной радиочастотной абляции АВсоединения (нет исследований по оценке исхода без электрокардиостимуляции, стимуляция всегда планируется в данных ситуациях, за исключением тех случаев, когда была выполнена процедура модификации АВ-соединения);
5) АВ-блокада после кардиохирургических вмешательств, когда не ожидается ее спонтанное разрешение;
6) нейромышечные заболевания в сочетании с АВ-блокадой, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с симптомами или без них, так как возможно непредвиденное ухудшение АВ-проводимости.
2. АВ-блокада II степени вне зависимости от типа и уровня поражения при сочетании с симптомной брадикардией.
Класс IIa:
1. Асимптомная АВ-блокада III степени на любом анатомическом уровне со средней частотой сокращения желудочков при пробуждении 40 уд/мин или более, особенно при наличии кардиомегалии или дисфункции левого желудочка.
2. Асимптомная АВ-блокада II степени тип Мобиц II с узким комплексом QRS (когда при АВ-блокаде II степени тип Мобиц II имеется широкий комплекс QRS, класс рекомендации становится первым).
3. Асимптомная АВ-блокада I степени на интраили инфрагисиальном уровне, выявленная при электрофизиологическом исследовании, проведенном по другому поводу.
4. АВ-блокада I или II степени с симптоматикой, сходной с синдромом электрокардиостимулятора.
Класс IIb:
1. Значимая АВ-блокада I степени (P-Q более 300 мс) у пациентов с дисфункцией левого желудочка и симптомами застойной сердечной недостаточности, у которых укороченная АВ-задержка приводит к улучшению гемодинамики, предположительно за счет снижения давления наполнения левого предсердия.
2. Нейромышечные заболевания, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с любой степенью АВ-блокады, симптоматичная или нет, так как возможно непредвиденное ухудшение АВ-проводимости.
Класс III:
1. Асимптомная АВ-блокада I степени.
2. Асимптомная АВ-блокада I степени на супрагисиальном уровне (уровень АВ-узла) или при отсутствии данных об интраили инфрагисиальном уровне блока.
3. Ожидаемое разрешение АВ-блокады и/или малая вероятность ее рецидива (например, токсическое действие лекарств, болезнь Лайма, гипоксия при апноэ во время сна в отсутствие симптоматики).
при хронической бифасцикулярной и трифасцикулярной блокаде
(ACC/AHA/NASPE, 2002)
Класс I:
1. Преходящая АВ-блокада III степени.
2. АВ-блокада II степени тип Мобиц II.
3. Альтернирующая блокада ножек пучка Гиса.
Класс IIa:
1. Синкопальные состояния при недоказанной связи с АВ-блокадой, когда другие их причины исключены, в особенности желудочковая тахикардия.
2. Случайно выявленное при электрофизиологическом исследовании значительное удлинение интервала H-V (более 100 мс) у асимптомных пациентов.
3. Случайно выявленный при электрофизиологическом исследовании нефизиологический инфрагисиальный блок, вызванный стимуляцией.
Класс IIb:
Нейромышечные заболевания, такие как миотоническая мышечная дистрофия, синдром Кернса-Сейра, дистрофия Эрба (опоясывающая) и перонеальная мышечная атрофия, с любой степенью фасцикулярной блокады, с симптоматикой или без, так как возможно непредвиденное ухудшение атриовентрикулярного проведения.
Класс III:
1. Фасцикулярная блокада без АВ-блокады и клинической симптоматики.
2. Асимптомная фасцикулярная блокада в сочетании с АВ-блокадой I степени.
Показания к постоянной электрокардиостимуляции при атриовентрикулярных блокадах при остром инфаркте миокарда
(ACC/AHA/NASPE, 2002)
При возникновении симптоматической брадикардии, обусловленной нарушением атриовентрикулярной проводимости в остром периоде инфаркта миокарда, некурабельной медикаментозно, показано проведение временной эндокардиальной электрокардиостимуляции. Данный вид электрокардиотерапии целесообразно использовать 12-14 дней. Согласно рекомендациям ACC/AHA по лечению пациентов с острым инфарктом миокарда, потребность во временной электрокардиостимуляции в острый период инфаркта миокарда сама по себе не определяет показаний к постоянной электрокардиостимуляции. По истечении вышеуказанного периода времени устанавливается степень нарушения АВ-проводимости, ее необратимость и определяются показания к проведению постоянной электрокардиотерапии.
Показания к постоянной электрокардиостимуляции у пациентов, перенесших инфаркт миокарда, осложненный нарушением атриовентрикулярной проводимости, в большей степени обусловлены нарушениями внутрижелудочковой проводимости. В отличие от показаний к постоянной электрокардиотерапии нарушений АВ-проводимости, критерии для отбора пациентов с инфарктом миокарда часто не зависят от наличия симптомной брадикардии. При рассмотрении показаний к постоянной электрокардиостимуляции у данной категории больных должны быть учтены тип нарушения атриовентрикулярной проводимости, локализация инфаркта миокарда и констатирована причинно-следственная связь указанных электрических нарушений с ним.
при приобретенных нарушениях атриовентрикулярной проводимости
после острого инфаркта миокарда (ACC/AHA/NASPE, 2002)
Класс I:
1. Персистирующая АВ-блокада II степени в системе ГисаПуркинье с билатеральной блокадой ножек пучка Гиса или АВ-блокада III степени на уровне или ниже системы Гиса-Пуркинье после острого инфаркта миокарда.
2. Транзиторная, далеко зашедшая (АВ-блокада II или III степени) инфранодальная АВ-блокада в сочетании с блокадой ножек пучка Гиса. Если уровень АВ-блокады неясен - показано проведение электрофизиологического исследования.
3. Персистирующая и симптомная АВ-блокада II или III степени.
Класс IIb:
1. Персистирующая АВ-блокада II или III степени на уровне атриовентрикулярного соединения.
Класс III:
1. Транзиторная АВ-блокада при отсутствии нарушений внутрижелудочковой проводимости.
2. Транзиторная АВ-блокада при изолированной блокаде передней ветви левой ножки пучка Гиса.
3. Появившаяся блокада передней ветви левой ножки пучка Гиса при отсутствии АВ-блокады.
4. Персистирующая АВ-блокада I степени при ранее имевшейся блокаде ножки пучка Гиса неизвестной давности.
5. Эхокардиография.
6. Тил т-тест.
8. Чреспищеводное электрофизиологическое исследование.
ИМПЛАНТИРУЕМЫЕ КАРДИОВЕРТЕРЫДЕФИБРИЛЛЯТОРЫ У ПАЦИЕНТОВ КАТЕГОРИИ ВЫСОКОГО РИСКА ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ
Имплантация кардиовертеров-дефибрилляторов
Технически процедура установки имплантируемого кардиовертера-дефибриллятора (ИКД) мало отличается от имплантации постоянных электрокардиостимуляторов. Перед операцией с помощью программатора оценивают состояние батареи устройства и функцию конденсатора, а антибрадикардитическую стимуляцию и функции ИКД-терапии отключают. После установки электродов в камерах сердца проводят их тестирование с помощью наружного стимулятора. В пекторальной области подкожно или субфасциально формируют ложе аппарата ИКД, который коммутируется с имплантированными электродами. С помощью программатора устанавливают параметры детекции и терапии. Затем проводится определение порога дефибрилляции и эффективность запрограммированного алгоритма ИКДтерапии. Для этого пациенту проводят кратковременный внутривенный наркоз и с помощью программатора индуцируют фибрилляцию желудочков (режимы T-shock (разряд дефибриллятора, синхронизированный с Т-волной) или 50 Hz burst-pacing)). При оптимально установленных параметрах терапии устройство должно нанести разряд и купировать фибрилляцию желудочков. Величина энергии разряда ИКД, устанавливаемая в устройстве, должна в 2 раза превышать величину порога дефибрилляции. При неэффективной терапии
ИКД неотложные мероприятия осуществляют с помощью наружного дефибриллятора.
Основы терапии кардиовертерами-дефибрилляторами
Современный ИКД представляет собой систему, состоящую из устройства, заключенного в небольшой титановый корпус, и одного или более электродов, установленных в камеры сердца. Аппарат содержит источник питания (литиево-серебряно-ваннадиевую батарею), преобразователь напряжения, резисторы, конденсатор, микропроцессор, системы анализа сердечного ритма и высвобождения разряда, а также базу данных электрограмм аритмических событий. В клинической практике используются желудочковые и предсердные электроды как с пассивным, так и с активным механизмами фиксации для проведения дефибрилляции, антитахикардической, антибрадикардической электрокардиостимуляции и ресинхронизирующей терапии. На сегодняшний день применяются одно-, двух- и трехкамерные (бивентрикулярные) системы. В большинстве систем само устройство, заключенное в титановый корпус, является частью цепи разряда дефибриллятора (рис. 2.8).
 Рис. 2.8.
Имплантируемый кардиовертер-дефибриллятор. Примечание.
(1)
титановый корпус, (2) внутрисердечный электрод. Цепь разряда
имплантируемого кардиовертера-дефибриллятора заключена между корпусом
устройства и катушкой (3), находящейся на электроде. С помощью
дистального кончика электрода (4) осуществляется детекция аритмических
событий и проведение антитахи- и антибрадистимуляции
Рис. 2.8.
Имплантируемый кардиовертер-дефибриллятор. Примечание.
(1)
титановый корпус, (2) внутрисердечный электрод. Цепь разряда
имплантируемого кардиовертера-дефибриллятора заключена между корпусом
устройства и катушкой (3), находящейся на электроде. С помощью
дистального кончика электрода (4) осуществляется детекция аритмических
событий и проведение антитахи- и антибрадистимуляции
Таблица 2.5
Режимы антитахикардитической стимуляции
 Функции имплантируемых кардиовертеров-дефибрилляторов
Функции имплантируемых кардиовертеров-дефибрилляторов
1. Антитахикардитическая стимуляция (АТС).
Режимы подавляющей желудочковой стимуляции в зоне детекции желудочковых тахикардий представлены в табл. 2.5.
2. Кардиоверсия - низковольтный шок (разряд высокой энергии постоянного электрического тока), который наносится вне уязвимой фазы сердечного цикла (через 20-30 мс после вершины зубца R) в зоне детекции желудочковой тахикардии (ЖТ).
3. Дефибрилляция - высоковольтный шок (разряд высокой энергии постоянного электрического тока) в зоне детекции высокочастотной ЖТ и фибрилляции желудочков (ФЖ).
4. Антибрадикардитическая стимуляция - электрокардиостимуляция в зоне детекции брадикардии.
В основе детекции аритмий лежит анализ R-R интервалов, форма желудочкового сигнала, стабильность R-R интервалов, соотношение характеристик предсердной и желудочковой активности (в двухкамерных системах). Входящий сигнал проходит фильтрацию, в результате которой элиминируются и не подвергаются детекции низкочастотные (обусловленные Т-волной) и высокочастотные компоненты (обусловленные активностью скелетной мускулатуры). Параметры детекции и алгоритмы терапии для каждой зоны устанавливаются интраоперационно во время тестирования устройства с помощью программатора (рис. 2.9). В зависимости от клинической ситуации проводимой медикаментозной терапии эти значения в дальнейшем могут корректироваться.
 Рис. 2.9.
Зоны детекции и возможные режимы работы кардиовертерадефибриллятора
Рис. 2.9.
Зоны детекции и возможные режимы работы кардиовертерадефибриллятора
Для предотвращения неоправданных разрядов во время суправентрикулярных аритмий, синусовой тахикардии применяются функции анализа стабильности R-R интервалов (при тахисистолической форме фибрилляции предсердий), морфологии желудочкового сигнала, регистрируемого желудочковым электродом, внезапности начала тахиаритмии (при возникновении ЖТ или ФЖ величина интервала R-R внезапно уменьшается), а также двухкамерная регистрация сигналов в предсердиях и желудочках. Алгоритм терапии подбирается врачом на основании переносимости больным клинической тахикардии. При ФЖ или быстрой ЖТ первым шагом в терапии является дефибрилляция, мощностью на 10 Дж превышающая интраоперационный порог дефибрилляции с последующим автоматическим нарастанием мощности разрядов до максимальных значений (30 Дж), а также изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот.
Профилактика внезапной сердечной смерти Определения
Внезапная сердечная смерть (ВСС) - смерть, развившаяся моментально или наступившая в течение часа с момента возникновения острых изменений в клиническом статусе пациента.
Сердечный арест - это состояние, сопровождающееся потерей сознания вследствие асистолии, желудочковой тахикардии или фибрилляции желудочков. Обязательным условием диагноза сердечного ареста является регистрация этих эпизодов электрокардиографическим методом.
Устойчивая желудочковая тахикардия - это тахикардия продолжительностью более 30 с.
Неустойчивая желудочковая тахикардия - это тахикардия от 3 комплексов до 30 с, которая самостоятельно прерывается.
Факторы риска - это клинические признаки, указывающие на вероятность развития ВСС у конкретного пациента в текущем году в процентах.
Профилактика внезапной сердечной смерти - это комплекс мероприятий, проводимых у лиц, переживших сердечный арест (вторичная профилактика), или у пациентов, имеющих высокий риск развития ВСС без эпизодов сердечного ареста в анамнезе (первичная).
Патофизиология внезапной сердечной смерти
Наиболее частыми электрофизиологическими механизмами развития ВСС являются желудочковая тахикардия и фибрилляция желудочков. Приблизительно в 20-30% случаев причинами ВСС являются брадиаритмия и асистолия. Часто довольно сложно определить первичный механизм ВСС у пациентов с документированной брадиаритмией, так как асистолия может быть следствием устойчивой ЖТ. С другой стороны, исходная брадиаритмия, обусловленная ишемией миокарда, может спровоцировать ЖТ или ФЖ. Ниже приводится этиология внезапной сердечной смерти по J. Ruskin (1998)
Ишемическая болезнь сердца Дилатационная кардиомиопатия Гипертрофия левого желудочка Гипертрофическая кардиомиопатия Приобретенные пороки сердца Врожденные пороки сердца Острый миокардит
Аритмогенная дисплазия правого желудочка
Аномалии развития коронарных артерий
Саркоидоз
Амилоидоз
Опухоли сердца
Дивертикулы левого желудочка
Синдром WPW
Синдром удлиненного интервала QT Лекарственная проаритмия Кокаиновая интоксикация Выраженный электролитный дисбаланс Идиопатическая желудочковая тахикардия
В большинстве случаев ВСС развивается у пациентов со структурной патологией миокарда. Пациенты с врожденными аритмическими синдромами при отсутствии морфологических изменений сердца составляют небольшой процент в структуре ВСС. На молеку-
Таблица 2.6
Эффективность терапии имплантируемыми кардиовертерами-дефибрилляторами
 Примечание.
ВСР
- вариабельность ритма сердца; ИБС - ишемическая болезнь сердца; ИМ -
инфаркт миокарда; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая
экстрасистолия; ХСН - хроническая сердечная недостаточность; ФВ -
фракция выброса; ЧСС - частота сердечных сокращений; эндо-ЭФИ -
эндокардиальное электрофизиологическое исследование; ФК - функциональный
класс
Примечание.
ВСР
- вариабельность ритма сердца; ИБС - ишемическая болезнь сердца; ИМ -
инфаркт миокарда; ЖТ - желудочковая тахикардия; ЖЭ - желудочковая
экстрасистолия; ХСН - хроническая сердечная недостаточность; ФВ -
фракция выброса; ЧСС - частота сердечных сокращений; эндо-ЭФИ -
эндокардиальное электрофизиологическое исследование; ФК - функциональный
класс
лярном уровне причинами электрической нестабильности миокарда могут быть изменения концентрации ионов калия и кальция, нейрогормональные сдвиги, мутации, обусловливающие дисфункцию натриевых каналов, что приводит к повышенному автоматизму и формированию re-entry.
Отбор пациентов для имплантации кардиовертеров-дефибрилляторов
В 1984 г. J.T. Bigger провел анализ вероятностной характеристики развития ВСС в каждом клиническом случае. Он выделил группы лиц с высоким и умеренным факторами риска развития ВСС. Данные представлены в табл. 2.7.
Таблица 2.7
Факторы риска внезапной сердечной смерти
Примечание. ОИМ - острый инфаркт миокарда; ФВ - фракция выброса; ЖЭ - частая желудочковая экстрасистолия; ЖТ - желудочковая тахикардия; ВСС - внезапная сердечная смерть.
Важно отметить, что эти данные нашли свое отражение в исследовании AVID, которое было проведено 13 лет спустя после работы J.T. Bigger. Таким образом, наиболее значимыми предикторами ВСС являются: дисфункция левого желудочка, эпизод сердечного ареста в анамнезе, гипертрофия миокарда, а также ряд заболеваний, основу которых составляет наличие электрически нестабильного миокарда (см. табл. 2.6).
Класс I:
1. Лица, пережившие сердечный арест, произошедший вследствие ФЖ или ЖТ, которые были обусловлены не транзиторными и обратимыми причинами (AVID-пациенты).
2. Пациенты со спонтанной, устойчивой ЖТ, верифицированной на ЭКГ или при холтеровском мониторировании в сочетании со структурной патологией сердца.
3. Пациенты с синкопальными состояниями неустановленной этиологии и с выявленной, гемодинамически значимой, устойчивой ЖТ или ФЖ, индуцированной во время ЭФИ. При этом постоянная ААТ неэффективна, плохо переносима или сам пациент не желает ее получать.
4. Пациенты с ИБС, указанием на ОИМ в анамнезе и неустойчивой ЖТ при имеющейся умеренно сниженной ФВ левого желудочка (ниже 35%), а также индуцированной ФЖ или устойчивой ЖТ во время ЭФИ, которая не подавляется антиаритмическими препаратами Ia класса (MADIT I-пациенты).
5. Пациенты с ФВ левого желудочка ниже 30% как минимум по прошествии одного месяца после ОИМ и трех месяцев после операции реваскуляризации миокарда (MADIT II- и SCD-HF-пациенты).
6. Пациенты со спонтанной, устойчивой ЖТ, верифицированной на ЭКГ или при холтеровском мониторировании без структурной патологии сердца, и которая не устраняется другими методами лечения.
Класс II:
1. Пациенты с указаниями в анамнезе на перенесенную ФЖ, которым проведение ЭФИ противопоказано.
2. Пациенты с плохо переносимой, гемодинамически значимой устойчивой ЖТ в периоде ожидания трансплантации сердца.
3. Пациенты с наследственными или приобретенными заболеваниями, которые сопровождаются высоким риском развития сердечного ареста вследствие ФЖ или ЖТ (синдром удлиненного интервала QT, гипертрофическая кардиомиопатия, синдром Бругада, аритмогенная дисплазия правого желудочка).
4. Пациенты с синкопальными состояниями в сочетании с дисфункцией левого желудочка и индуцированной во время эндо-ЭФИ ЖТ при исключении других причин развития синкопального состояния.
5. Пациенты с распространенной структурной патологией сердца и синкопальными состояниями, у которых предыдущие исследования не дали определенного результата в установлении причины.
Класс III:
1. Пациенты без структурной патологии сердца и синкопальными состояниями неясной этиологии без выявленной ЖТ во время ЭФИ, и когда другие причины развития синкопе не исключены окончательно.
2. Пациенты с постоянно рецидивирующей ЖТ.
3. Пациенты с идиопатическими ЖТ, которые могут быть успешно элиминированы радиочастотной катетерной деструкцией (идиопатические ЖТ из области выходных трактов правого и левого желудочков, ЖТ с циркуляцией импульса по проводящей системе сердца (bundle branch re-entry) и др.
4. Пациенты с желудочковыми нарушениями ритма, возникающими вследствие транзиторных и обратимых причин (расстройства электролитного баланса, острые отравления, эндокринные нарушения, применение адреномиметиков и проч.).
5. Больные с выраженными психическими расстройствами, которые могут препятствовать наблюдению за больным в раннем и отдаленном послеоперационном периодах.
6. Пациенты с терминальными заболеваниями, у которых предполагаемый прогноз продолжительности жизни менее 6 мес.
7. Пациенты с ишемической болезнью сердца без индуцированной в ходе эндо-ЭФИ ЖТ, с дисфункцией левого желудочка, которым планируется проведение реваскуляризационных мероприятий.
8. Пациенты с IV функциональным классом сердечной недостаточности по NYHA, рефрактерной к медикаментозной терапии, и пациенты, которые не могут быть кандидатами на трансплантацию сердца.
Программа инструментального обследования пациентов
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Рентгенография органов грудной клетки.
5. Эхокардиография.
6. Тилт-тест.
7. УЗДГ брахиоцефальных артерий.
8. Коронарография.
9. Эндокардиальное электрофизиологическое исследование (при необходимости).
ИСПОЛЬЗОВАНИЕ РЕСИНХРОНИЗИРУЮЩЕЙ ЭЛЕКГРОКАРДИОТЕРАПИИ У ПАЦИЕНТОВ С ВЫСОКИМ ФУНКЦИОНАЛЬНЫМ КЛАССОМ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Имплантация кардиоресинхронизирующих устройств
За исключением установки электрода для стимуляции левого желудочка сердца методика имплантации кардиоресинхронизирующего устройства (КРСУ) мало чем отличается от хирургической техники имплантации двухкамерного ЭКС. На первом этапе имплантации КРСУ осуществляется установка предсердного и правожелудочкового эндокардиальных электродов (рис. 2.10, панель В). При имплантации желудочкового электрода с пассивным механизмом фиксации последний необходимо установить в области верхушки, ближе к межжелудочковой перегородке, таким образом, чтобы кончик электрода проецировался вблизи тени диафрагмы, что обеспечивает наилучшую фиксацию. Желудочковые электроды с активным механизмом фиксации можно позиционировать в области межжелудочковой перегородки или выходном тракте правого желудочка сердца.
Эндокардиальные J-образные предсердные электроды с пассивной фиксацией устанавливаются в ушке правого предсердия. При имплантации предсердных электродов с активным механизмом фиксации возможно их позиционирование как в ушке правого предсердия, так и в области межпредсердной перегородки.
На следующем этапе операции выполняют катетеризацию и контрастирование коронарного синуса (рис. 2.10, панель А). Наиболее выраженный клинический эффект бивентрикулярной стимуляции может быть достигнут при позиционировании левожелудочкового электрода в латеральной, переднелатеральной или заднелатеральной венах сердца (рис. 2.10, панель Б). Установка электрода в большой или средней вене сердца приводит к стимуляции переднего или

 Рис. 2.10.
Имплантация
электродов кардиоресинхронизирующего устройства. Панель А:
контрастирование коронарного синуса. Панель Б: имплантация
левожелудочкового электрода трансвенозным доступом через коронарный
синус в латеральную вену сердца. Панель В: схема расположения электродов
кардиоресинхронизирующего устройства
Рис. 2.10.
Имплантация
электродов кардиоресинхронизирующего устройства. Панель А:
контрастирование коронарного синуса. Панель Б: имплантация
левожелудочкового электрода трансвенозным доступом через коронарный
синус в латеральную вену сердца. Панель В: схема расположения электродов
кардиоресинхронизирующего устройства
верхушечного сегментов левого желудочка, что ассоциируется с увеличением степени митральной регургитации и, следовательно, сопровождается отрицательным гемодинамическим эффектом. Для проведения и установки левожелудочкового электрода в венозные сосуды системы коронарного синуса используют специальный набор инструментария - систему доставки электрода коронарного синуса.
Желудочковая десинхронизация как звено патогенеза хронической сердечной недостаточности
В основе синдрома хронической сердечной недостаточности (ХСН) лежит диастолическая и/или систолическая дисфункция
левого желудочка. ХСН характеризуется прогрессирующим течением и сопровождается процессом ремоделирования левого желудочка, который проявляется изменением геометрии камер сердца в виде их гипертрофии и/или дилатации. Возникающие механические нарушения в работе сердца как насоса способствуют поддержанию и прогрессированию процессов ремоделирования, а также сопровождаются сложными компенсаторными и патофизиологическими изменениями, включающими в себя в том числе нарушения фазовой структуры сердечного цикла (рис. 2.11).
 Рис. 2.11.
Нарушение фазовой структуры сердечного цикла. Примечание:
Панель
А: схематическое изображение нарушения фазовой структуры сердечного
цикла при блокаде левой ножки пучка Гиса. Обращает на себя внимание
увеличение периода предызгнания и уменьшение времени наполнения левого
желудочка. Панель Б: Нормализация фазовой структуры сердечного цикла в
результате проведения ресинхронизирующей терапии. Происходит
синхронизация систолы правого и левого желудочков, увеличение времени
наполнения левого желудочка и сокращение периода предызгнания
Рис. 2.11.
Нарушение фазовой структуры сердечного цикла. Примечание:
Панель
А: схематическое изображение нарушения фазовой структуры сердечного
цикла при блокаде левой ножки пучка Гиса. Обращает на себя внимание
увеличение периода предызгнания и уменьшение времени наполнения левого
желудочка. Панель Б: Нормализация фазовой структуры сердечного цикла в
результате проведения ресинхронизирующей терапии. Происходит
синхронизация систолы правого и левого желудочков, увеличение времени
наполнения левого желудочка и сокращение периода предызгнания
Нарушения внутрижелудочковой проводимости (в 90% случаев в форме блокады левой ножки пучка Гиса (БЛНПГ)) встречаются у 35% пациентов с ХСН. При этом имеется прямая корреляция между длительностью комплекса QRS и смертностью среди этой группы пациентов с ХСН (рис. 2.12).

Рис. 2.12. Выживаемость среди пациентов с хронической сердечной недостаточностью в зависимости от длительности желудочкового комплекса
Нарушения проведения по ножкам системы Гиса-Пуркинье приводят к механической меж- и внутрижелудочковой десинхронизации. Наиболее ярко это выражено при БЛНПГ. В этом случае происходит чередование активного сокращения и пассивного растяжения контралатеральных областей левого желудочка: ранне-систолическое сокращение межжелудочковой перегородки с растяжением боковой стенки левого желудочка и последующее поздне-систолическое сокращение латеральной стенки с выраженным конечно-систолическим перерастяжением межжелудочковой перегородки. В результате происходит пассивное смещение межжелудочковой перегородки в сторону правого желудочка, ошибочно называемое «парадоксальным». Существующая последовательность деполяризации миокарда левого желудочка ведет к уменьшению длительности фазы быстрого наполнения левого желудочка, задержке сокращения левого желудочка и замедлению общей продолжительности систолического выброса из него, уменьшению времени диастолического расслабления и наполнения левого желудочка, увеличению периода предыз-
гнания (см. рис. 2.11). Изменения фаз сердечного цикла в условиях десинхронизации приводят к увеличению конечно-систолического и конечно-диастолического давлений в полостях сердца, уменьшению фракции изгнания и фракции укорочения волокон левого желудочка, повышению давления в легочной артерии, являясь отражением прогрессирования систолической и диастолической дисфункции у пациентов с ХСН.
Появление патологической митральной регургитации у пациентов с ХСН служит неблагоприятным прогностическим признаком. Значительный вклад в ее формирование вносят наличие подклапанной дисфункции левого желудочка, дискоординации движения групп папиллярных мышц и перерастяжение фиброзного кольца. При наличии БЛНПГ раннее активное движение межжелудочковой перегородки, возникающее до закрытия створок митрального клапана, также ведет к появлению нечеткости границы между диастолой и систолой, что может усиливать степень митральной регургитации.
Патологическое систолическое растяжение поперечных мышечных мостиков левого желудочка создает условия для поддержания re-entry и увеличивает вероятность появления жизнеугрожающих желудочковых нарушений ритма сердца.
Представленные механизмы десинхронизации у пациентов с ХСН снижают эффективность сократительной функции сердца и сопровождаются повышением энергозатрат, что ухудшает его функциональное состояние независимо от этиологического фактора сердечной недостаточности.
Десинхронизация складывается из нескольких компонентов: предсердно-желудочкового, межжелудочкового и внутрижелудочкового.
Первый компонент отражает разобщение координации систолы предсердий и желудочков. В клинической практике для верификации предсердно-желудочковой десинхронизации используется оценка трансмитрального потока допплеровским методом при выполнении трансторакальной эхокардиографии (Эхо-КГ). Слияние пиков Е (пассивное диастолическое наполнение предсердий) и А (систола предсердий) иллюстрирует предсердно-желудочковую десинхронизацию (рис. 2.13).
Показателями межжелудочковой десинхронизации являются длительность комплекса QRS более 120 мс, задержка движения латеральной стенки левого желудочка относительно движения межжелудочковой перегородки более 140 мс, регистрируемая во время
 Рис. 2.13.
Определение
трансмитрального кровотока допплеровским методом у пациента с
имплантированным КРСУ и установленной величиной АВ-задержки 140 мс.
Рис. 2.13.
Определение
трансмитрального кровотока допплеровским методом у пациента с
имплантированным КРСУ и установленной величиной АВ-задержки 140 мс.
Примечание. В левой части рисунка потоки Е и А, характеризующие пассивное диастолическое наполнение и предсердную систолу, неразличимы. В правой части рисунка представлены данные допплерографии у того же пациента при изменении величины АВ-задержки (было установлено 110 мс). Отмечается расхождение пиков Е (первый, низкоамплитудный) и А (второй, высокоамплитудный), свидетельствующих об оптимизации диастолического наполнения
проведения Эхо-КГ в М-режиме, увеличение показателя кумулятивной асинхронии более 100 мс при проведении тканевого допплеровского сканирования, разница интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии, превышающая 40 мс (рис. 2.14, 2.15, см. на вклейке).
Внутрижелудочковая десинхронизация может быть верифицирована методом тканевой допплерографии. Использование различных режимов тканевой допплерографии позволяет отразить задержку между началом комплекса QRS на поверхностной ЭКГ и появлением тканевого допплеровского сигнала, отображающего систолическую волну в соответствующих сегментах миокарда левого желудочка (рис. 2.16, см. на вклейке).
Внутрижелудочковая десинхронизация является независимым предиктором неблагоприятного течения сердечно-сосудистых заболеваний у пациентов, перенесших инфаркт миокарда.
 Рис. 2.14.
Признаки межжелудочковой десинхронизации. Примечание.
М-режим
трансторакальной эхокардиографии: верифицируется задержанное сокращение
латеральной стенки левого желудочка относительно межжелудочковой
перегородки у пациента с блокадой левой ножки пучка Гиса
Рис. 2.14.
Признаки межжелудочковой десинхронизации. Примечание.
М-режим
трансторакальной эхокардиографии: верифицируется задержанное сокращение
латеральной стенки левого желудочка относительно межжелудочковой
перегородки у пациента с блокадой левой ножки пучка Гиса
Таблица 2.8
Клинические эффекты ресинхронизирующей терапии
 Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции
Выбор режима и определение параметров ресинхронизирующей электрокардиостимуляции
Порядок тестирования КРСУ мало отличается от тестирования обычного электрокардиостимулятора. Дополнительно в ходе проверки КРСУ проводят определение параметров, относящихся к левожелудочковому электроду (порог электрокардиостимуляции, импеданс). В устройствах, не обладающих функцией отдельного программирования левожелудочкового канала электрокардиостимуляции, в ходе определения порога стимуляции целесообразно мониторирование ЭКГ в 12 отведениях. Если во время данного теста происходит изменение морфологии стимулированного желудочкового комплекса на поверхностной ЭКГ при сохраняющемся желудочковом захвате, то это свидетельствует о том, что достигнут порог стимуляции в одном из желудочковых каналов. При этом желудочковые «захваты» осуществляются благодаря более низкой величине порога стимуляции во втором желудочковом канале. На основании анализа 12 отведений ЭКГ можно определить, какой режим стимуляции используется у пациента (табл. 2.9 и рис. 2.17, см. на вклейке).
Таблица 2.9
Морфология комплекса QRS в отведениях I, III и V 1 при проведении различных видов электрокардиостимуляции
 Пациенты с синусовым ритмом
Пациенты с синусовым ритмом
При отсутствии у пациента с имплантированным КРСУ хронической фибрилляции предсердий важным моментом является оптимизация предсердно-желудочковой ресинхронизации методом под-
бора оптимальных параметров АВ-задержки. Существуют несколько методик определения этой величины. Наиболее часто используется формула Риттера, которая позволяет вычислить оптимальную величину АВ-задержки на основании регистрации формы трансмитрального потока, регистрируемого в М-режиме при трансторакальной эхокардиографии:
ABопт. - ABдл. + QAдл. - QA.коротк.
АВ дл - величина устанавливается на программаторе и составляет 75% от интервала PQ.
АВ коротк - величина устанавливается на программаторе и составляет 25% от интервала PQ.
QA дл - измеряется от начала стимуляционного желудочкового комплекса (Q) до конца пика А при запрограммированной удлиненной АВ-задержке (АВ дл.).
QА кOрOTK - измеряется от начала стимуляционного желудочкового комплекса (Q) до конца пика А при запрограммированной короткой АВ-задержке (АВ коротк).
В ряде случаев АВ-задержка программируется на основании визуальной регистрации оптимальной формы пиков трансмитрального потока (рис. 2.13). Особо подчеркнем, что величина программируемой АВ-задержки должна быть меньше величины интервала PQ, так как только в этом случае будет обеспечиваться постоянная бивентрикулярная стимуляция.
Оптимизация параметров межжелудочковой ресинхронизации возможна только в аппаратах, обладающих функцией отдельного программирования лево- и правожелудочкового каналов. Установка величины межжелудочковой задержки в диапазоне 5-20 мс с левожелудочковым опережением является оптимальной в гемодинамическом отношении, по сравнению с одновременной право- и левожелудочковой стимуляцией. При этом целесообразно проводить подбор величины межжелудочковой задержки под эхокардиографическим контролем методом вычисления разницы интервалов от начала комплекса QRS до начала потока в аорте и легочной артерии (не более 40 мс) и задержки движения латеральной стенки левого желудочка относительно межжелудочковой перегородки (не более 40 мс).
Пациенты с хронической формой фибрилляции предсердий
В этой категории пациентов подбор АВ-задержки невозможен, так как систола предсердий отсутствует как таковая. Поэтому ключевым моментом является достижение постоянной бивентрикулярной стимуляции за счет установки частоты ЭКС не ниже 70-80 в минуту и контроля частоты желудочковых сокращений. Нормосистолия достигается либо медикаментозным подавлением АВ-проведения, либо проведением модификации атриовентрикулярного соединения методом радиочастотной деструкции. Принципы оптимизации межжелудочковой ресинхронизации не отличаются от тех, которые применимы в отношении пациентов с синусовым ритмом.
По данным клинических исследований, установлено, что приблизительно у 25-30% пациентов с высоким функциональным классом ХСН не отмечается положительного эффекта от проведения кардиоресинхронизации по ряду причин. Во-первых, это отсутствие выраженных признаков десинхронизации правого и левого желудочков до имплантации системы. Во-вторых, неадекватное позиционирование электрода для левожелудочковой стимуляции. Электростимуляция латеральной стенки левого желудочка более эффективна через электрод, проведенный в латеральную или заднелатеральную вены сердца. В то же время электростимуляция из сердца или большой вены сердца часто не оказывает положительного влияния на систолическую функцию левого желудочка. В-третьих, некорректная установка параметров кардиоресинхронизации. Улучшение клинической симптоматики возникает только при условии постоянной бивентрикулярной стимуляции.
Показания к имплантации кардиоресинхронизирующих устройств (ЕСС/ACC/AHA, 2005)
Класс I:
1. Сердечная недостаточность III/IV ФК (NYHA), несмотря на оптимальную медикаментозную терапию.
2. Длительность комплекса QRS >130 мс.
3. Фракция выброса левого желудочка <35%.
4. Конечно-диастоличсекий размер левого желудочка >55 мм.
5. Эхокардиографические признаки желудочковой десинхронизации.
Программа инструментального обследования пациентов
2. Суточное мониторирование ЭКГ.
3. Проба с физической нагрузкой.
4. Тест с 6-минутной ходьбой.
5. Рентгенография органов грудной клетки.
6. Эхокардиография.
7. Коронарография.
В настоящее время все чаще при лечении нарушений ритма и проводимости различного генеза используется электрокардиостимуляция. С развитием прогресса совершенствуются и имплантируемые электрокардиостимуляторы (ЭКС): на смену однокамерным ЭКС, работавшим в асинхронном режиме, пришли двухкамерные стимуляторы, обеспечивающие необходимую частоту ритма. Последние модели ЭКС - это сложные устройства с широкими возможностями программирования их функций. При этом с усложнением кардиостимуляционной техники расширяются как ее возможности в контроле ритма пациентов, так и трудности в интерпретации регистрируемого на ЭКГ функционирования постоянных ЭКС.
Интерпретация результатов суточного мониторирования электрокардиограммы (СМ ЭКГ) играет важную роль в оценке функционирования имплантированного аппарата, что помогает в грамотном ведении пациента. Нами проведена попытка анализа СМ ЭКГ у пациентов, не обнаруживших каких-либо дисфункций при стандартной регистрации кардиограммы и «опросе» (interrogation) имплантированных устройств.
Во время СМ ЭКГ оценивались следующие параметры работы ЭКС:
- Эффективность, т.е. соответствие спайков и признаков возбуждения камер сердца.
- Отсутствие или наличие нарушений восприятия (детекции) каким-либо каналом (гипо- или гиперсенсинг).
- Нарушения ритма, связанных с работой ЭКС.
- Изменения запрограммированных параметров стимуляции.
СМ ЭКГ проводили на системе фирмы «Siemens». Обследовано 124 пациента в возрасте от 23 до 80 лет, из них 69 мужчин и 55 женщин. Показаниями к установке ЭКС были дисфункция синусового узла (СССУ, преходящий отказ синусового узла) с развитием синкопальных состояний, недостаточности кровообращения - у 48 больных; атриовентрикулярные блокады 2–3 степени врожденные или приобретенные (в том числе после операций радиочастотной аблации АВ соединения по поводу пароксизмальных суправентрикулярных тахикардий) - у 58 больных, у 16 обследованных было сочетанное поражение синусового и АВ узла. Двум пациентам по поводу пароксизмов желудочковой тахикардии (ЖТ) был имплантирован кардиовертер-дефибриллятор (ИКД).
У 63 обследованных была однокамерная стимуляция, при этом были имплантированы отечественные аппараты ЭКС-300, ЭКС-500, ЭКС-501, ЭКС-511, ЭКС-532, ЭКС-3000. У 60 больных - двухкамерная стимуляция: аппараты «Sigma», «Kappa» фирмы Medtronic; «Pikos», «Axios», «Kairos», «Мetros», «Ergos» фирмы Biotronik, «Vita 2», «Selection» фирмы Vitatron и отечественный аппарат ЭКС-4000. У одного пациента был имплантирован бивентрикулярный ЭКС «InSync» фирмы Medtronic.
У всех обследованных больных при записи обычной ЭКГ нарушений в работе ЭКС не выявлено. При СМ ЭКГ эффективная стимуляция была у 119 пациентов (96%), эпизоды неэффективной стимуляции желудочков (рис. 1) - у 3 пациентов (2%) и эпизоды неэффективной стимуляции предсердий - у 3 пациентов (2%).Частота включений ЭКС у различных больных отличалась: от единичных до 100% навязанных комплексов. Однако даже СМ ЭКГ позволяет лишь констатировать факты нарушения стимуляции, но не указывает на их причины, которых может быть несколько: дислокация электрода, его поломка, истощение батареи, повышение порога стимуляции и др.

Нарушение восприятия биопотенциалов каким-либо каналом (гипо-, гиперсенсинг) также может быть обусловлено различными причинами: неадекватные по амплитуде биосигналы, дислокация электрода, его поломка, разряд батареи, избыточное восприятие миопотенциалов, детекция зубцов Р или Т желудочковым каналом, детекция зубцов R, T или U предсердным каналом и др. Современные ЭКС способны к сенсингу предсердной и/или желудочковой активности. Усложнение систем направлено на обеспечение атриовентрикулярной (АВ) синхронизации, устранение отрицательных электронных взаимодействий между каналами ЭКС и неблагоприятных взаимодействий навязанного и спонтанного ритмов.
Снижение чувствительности в каком-либо канале выявлены у 32 больных (25,6%), в том числе гипосенсинг Р-волны при однокамерной предсердной стимуляции (рис. 2), гипосенсинг R-волны при однокамерной стимуляции желудочков, гипосенсинг Р-волны при двухкамерной стимуляции (рис. 3), гипосенсинг R-волны при двухкамерной стимуляции, гипосенсинг и Р- и R-волн при двухкамерной стимуляции. Данные нарушения чувствительности явились по нашим данным наиболее распространенным видом дисфункций стимулирующих систем. При этом очевидной становится лимитированная информативность определения амплитуды эндокардиального сигнала при стандартном программировании ЭКС (в положении лежа). Повседневная физическая активность пациента с мониторированием ЭКГ позволяет диагностировать неадекватное программирование параметров и предопределяет более точный индивидуальный подбор показателей и полярности (моно- или биполярная) чувствительности приборов.


Гиперсенсинг в одном из каналов выявлен у 19 пациентов (15,3%). Это проявлялось детекцией потенциалов грудной мышцы предсердным каналом ЭКС (рис. 4) или детекцией миопотенциалов желудочковым каналом, что вызывало ингибирование выхода очередного желудочкового стимула и появление пауз в работе ЭКС (рис. 5). У 12 пациентов (9,7%) причиной повышенной чувствительности желудочкового канала с развитием пауз в работе ЭКС были различные технические нарушения.

На основании вышеописанных наблюдений нами проводятся пробы с нагрузкой на плечевой пояс при первичном программировании параметров чувствительности имплантированного ЭКС. Находясь в положении лежа, пациент под мониторным контролем ЭКГ оказывает давление в различных направлениях на руку врача. При этом воспроизводимость миопотенциального ингибирования достигает 85% в сравнении с СМ ЭКГ. Это помогает более адекватно программировать параметры чувствительности каналов ЭКС и при необходимости, а также возможности, переводить детекцию в биполярный режим. Данная методика позволяет обеспечить адекватность и надежность функционирования ЭКС в плане предотвращения гемодинамически значимых пауз и предупреждать возможные синкопальные и пресинкопальные состояния, связанные с феноменом детекции аппаратом активности скелетных мышц.
Говоря об избыточной детекции, следует также учитывать возможность восприятия предсердным каналом ритмоводителя желудочковой активности (как стимулированного, так и спонтанного желудочкового сокращения), что может приводить к «замедлению» работы прибора. Базовый интервал предсердного канала запускается от воспринятой активности желудочка. Данное нарушение чаще может наблюдаться при позиционировании предсердного электрода активной фиксации в область нижней трети межпредсердной перегородки. Потенциально возможный противоположный вариант избыточной чувствительности (восприятие желудочковым каналом предсердного стимула (crosstalk) с потенциальным развитием асистолии желудочков) ни разу не отмечен нами при фабричных установках «слепого периода» и чувствительности желудочкового канала и возможен лишь при неадекватном программировании данных параметров.
Аритмии могут быть спонтанными или связанными с работой ЭКС, последние принято называть пейсмекерными. Из аритмий, связанных с работой ЭКС, у 1 пациента (0,8%) выявлена пейсмекерная желудочковая экстрасистолия. Дифференцировать желудочковую экстрасистолию, вызванную основным заболеванием, от той, что обусловлена стимуляцией, помогают следующие критерии: идентичность всех экстрасистолических комплексов, регистрируемых после навязанных; стабильность интервала сцепления; исчезновение экстрасистолии после отключения ЭКС. У 4 пациентов (3,2%) выявлены пароксизмы «пейсмекерной» тахикардии (ПМТ) на фоне сохраненного вентрикулоатриального (ВА) проведения (рис. 6). Наличие ВА проведения без развития «эхо-сокращений» при желудочковой стимуляции может не приводить к каким-либо нежелательным явлениям, а иногда препятствует развитию суправентрикулярных аритмий. Но при двухкамерной стимуляции сохраненное ВА-проведение может создать основу для развития круговой ПМТ.
«Пейсмекерная» аллоритмия была успешно корригирована уменьшением параметров энергии стимула. Что касается пейсмекер-опосредованной тахикардии (pacemaker mediated «endless loop» tachycardia), то в большинстве случаев она легко предотвращается адекватным удлинением предсердной рефрактерности, что обеспечивает попадание ретроградно проведенной желудочковой активности в период невосприимчивости предсердного канала. Определение продолжительности ретроградного ВА проведение имеет особую актуальность при отсутствии в ритмоводителе функции автоматического купирования «пейсмекерной» тахикардии, что делает ее возникновение гемодинамически опасным.
Помимо частоты, с которой осуществлялась стимуляция камер, оценивались и другие запрограммированные параметры: продолжительность АВ задержки, функция гистерезиса (увеличение базового интервала стимуляции для сохранения спонтанного ритма), ответ на нагрузку частотно-адаптивных стимуляторов, поведение ЭКС при достижении верхнего предела частоты трекинга (upper tracking limit), автоматическое переключение режима (mode switch).
Оптимальная АВ задержка должна обеспечивать синхронизацию предсердной и желудочковой систолы в покое и при физической нагрузке. При частотно-адаптивной двухкамерной стимуляции у 8 пациентов (6,5%) АВ задержка менялась в зависимости от частоты сердечных сокращений, но в пределах запрограммированного интервала (динамическая АВ задержка). Во многих современных ЭКС в режиме DDD устанавливается гистерезис АВ задержки, при котором автоматически укорачивается АВ интервал на запрограммированную величину при переключении предсердно-желудочковой стимуляции на Р-синхронизированную желудочковую стимуляцию.
Функция гистерезиса при стимуляции желудочков (увеличение базового интервала стимуляции для сохранения спонтанного ритма) была включена у 4 обследованных (3,2%). Выявленные при СМ ЭКГ значения гистерезиса также соответствовали запрограммированным параметрам (рис. 7).

При превышении частотой ритма предсердий верхнего предела частоты трекинга проведение предсердных импульсов на желудочки может меняться следующим образом: а) возникает режим деления (проведение 2:1, 3:1 и т.д.); б) возникает проведение с периодикой Венкебаха. Такое проведение при превышении верхнего предела частоты трекинга было выявлено у 8 пациентов (6,5%), как в режиме «деления» (рис. 8), так и в режиме периодики Венкебаха (рис. 9).


Чтобы избежать трекинга быстрых предсердных ритмов, в современных аппаратах имеется функция автоматического переключения режима (mode switch). При ее включении, если частота предсердного ритма превысит запрограммированную, стимулятор автоматически перейдет в режим работы с отсутствием триггерного ответа на предсердную активность (VVI, VDI, DDI). Срабатывание данной функции при СМ ЭКГ была выявлена у 3 обследованных (2,4%), у 2 из них были пароксизмы фибрилляции-трепетания предсердий (рис. 10), у 1 - предсердная экстрасистолия и ускоренный предсердный ритм (рис. 11).


Во многих современных устройствах существует так называемая функция превентивной желудочковой стимуляции, направленной против ингибирования желудочкового канала перекрестным сенсингом («ventricular safety pacing»). Когда предсердный электрод находится вблизи желудочкового, то предсердный стимул может детектироваться желудочковым каналом, вызывая ингибирование выхода желудочкового импульса. Для предотвращения этого было выделено специальное окно детекции вслед за желудочковым «слепым» периодом. Если активность детектируется в таком окне, то предполагается, что это был неадекватный сенсинг предсердного стимула, и ЭКС вместо подавления запускает выход желудочкового импульса в конце сокращенного АВ интервала. При СМ ЭКГ у одного пациента (аппарат фирмы «Vitatron») было выявлено включение функции превентивной желудочковой стимуляции (рис. 12).

Из нарушений спонтанного ритма можно отметить следующие: суправентрикулярная экстрасистолия – у 26 (21%), пароксизмы суправентрикулярной тахикардии (СВТ) – 11 (8,9%) и постоянная форма СВТ – у 5 больных (4%). Желудочковая экстрасистолия различных степеней градации по Лауну отмечена у 50 пациентов (40,3%), из них у 6 (4,8%), без ИКД, зарегистрированы пароксизмы ЖТ (рис. 13).

ИКД имплантируются при желудочковых тахиаритмиях и представляют из себя двухкамерный ЭКС с антитахикардитическими функциями (электростимуляция и разряд). В зависимости от вида нарушения ритма автоматически меняется и метод их устранения (различные виды антитахикардитической стимуляции, разная мощность разрядов). При анализе суточной ЭКГ у 2 больных с ИКД (1,6%) у одного из них отмечалась единичная желудочковая экстрасистолия, поэтому включений аппарата не было, у второго - пароксизмы ЖТ, купированные электростимуляцией (рис. 14).

Постоянная форма фибрилляции-трепетания предсердий регистрировалась у 16 (12,9%), пароксизмы фибрилляции-трепетания предсердий - у 12 больных (9,7%), из них у 4 был имплантирован однокамерный стимулятор и у 8 - двухкамерный. При фибрилляции предсердий ЭКГ-картина зависит от запрограммированной чувствительности ЭКС: если она превышает амплитуду самых высоких волн фибрилляции, то последние не детектируются и происходит предсердно-желудочковая стимуляция с базовой частотой, при этом ответа предсердий нет, т.к. они находятся в рефрактерном периоде.
Если чувствительность ЭКС больше самых низких, но меньше самых высоких волн фибрилляции, то, при отсутствии функции «mode switching», часть волн детектируется и возникает Р(f)-синхронизированная желудочковая стимуляция с частотой не выше верхнего предела, часть же волн не детектируется, и тогда неэффективные предсердные стимулы подаются с базовой частотой (рис. 15). Наконец, если чувствительность ЭКС меньше самых низких волн, то для профилактики частой желудочковой стимуляции, аппарат работает в режиме VVI.

У многих больных встречалась комбинация различных нарушений ритма. 19-ти больным (15,3%) с выявленными нарушениями в работе ЭКС после перепрограммирования, замены ЭКС (электрода) проводилось контрольное СМ ЭКГ. Таким образом, СМ ЭКГ играет важную роль в выявлении различных нарушений работы ЭКС, а также сопутствующих спонтанных аритмий, помогая клиницистам своевременно их устранить, тем самым, улучшить качество жизни пациентов.
ЛИТЕРАТУРА
- Ботоногов С.В., Борисова И.М. Роль холтеровского мониторирования ЭКГ в выявлении нарушений кардиостимуляции в раннем послеоперационном периоде. Вестник аритмологии. 2003, 32, с. 32-33.
- Григоров С.С.. Вотчал Ф.Б., Костылева О.В. Электрокардиограмма при искусственном водителе ритма сердца. М.. Медицина, 1990.
- Егоров Д.Ф., Гордеев О.Л. Динамическое наблюдение взрослых пациентов с имплантированными электрокардиостимуляторами. Руководство для врачей. С-Пб., 2004.
- Кушаковский М.С. Аритмии сердца. С-П., Фолиант, 1998, с.111-123.
- Мюжика Ж., Егоров Д.Ф., Серж Барольд. Новые перспективы в электрокардиостимуляции. С-Пб., Сильван, 1995.
- Трешкур Е.В., Порядина И.И., Юзвинкевич С.А. и др. Трудности интерпретации изменений ЭКГ, возникающих во время физической нагрузки у пациентов с электрокардиостимуляторами.Progress in Biomedical Research. 1998, февраль, том 3, с.67–73.
- Трешкур Т.В., Камшилова Е.А.. Гордеев О.Л. Электрокардиостимяция в клинической практике. С-П., Инкарт, 2002.
- Юзвинкевич С.А., Хирманов В.Н. Программирование атрио-вентрикулярной задержки как прием электрокардиотерапии. Progress in Biomedical Research. 1998, февраль, том 3, с.48-55.
















