И является важным компонентом системы фибринолиза . Активатор плазминогена является одним из ферментов, наиболее часто вовлекаемых в процессы деструкции базальной мембраны , внеклеточного матрикса и инвазии клеток . Он продуцируется эндотелием и локализован в стенке сосудов [ Loscalso, ea 1988 ]. Тканевой фактор представляет собой фосфолипопротеин. Апопротеин этого комплекса является интегральным мембранным гликопротеином с молек. массой около 46 кДа, который прочно ассоциирован с фосфолипидами мембран эндотелиальных , гладкомышечных клеток , моноцитов . ТАП синтезируется in vivo как одноцепочечный полипептид (молекулярная масса 72 кДа), который превращается в двуцепочечную форму в результате протеолиза различными протеиназами, включая плазмин, тканевой калликреин и активированный фактор X . Двуцепочечная форма тАП является более активной, чем одноцепочечный предшественник. рН-оптимум действия фермента при превращении ангиотензиногена в Анг II находится в кислой области . См. тАП как анг II образующий фермент . ТАП, определяемый в крови , представляет собой эндотелиальный активатор , высвобождаемый в кровоток под действием разных стимулов. Концентрация ТАП в крови равна 6,6+/-2,9 нг/мл.
Тканевый фактор - трансмембранный гликопротеин - член семейства рецепторов цитокинов II класса , может вызывать активацию клеток двумя механизмами.
Тканевой фактор, инициатор активации внешнего механизма свертывания крови , локализованный в эндотелиальных и гладкомышечных клетках при их повреждении вступает в контакт с кровью, что в конечном итоге способствует генерации тромбина и запуску механизма свертывания крови. Он обладает высоким сродством к циркулирующему в крови ф.VII . В присутствии ионов Са++ апопротеин Т.ф. образует стехиометрический комплекс с ф.VII, вызывая его конформационные изменения и превращая последний в сериновую протеиназу ф.VIIа путем расщепления Arg-152-Ile пептидной связи. Реакция стимулируется следовыми количествами протеиназ, циркулирующих в крови ( ф.Ха , тромбин , ф.VIIа , ф.IXа). Возникающий комплекс (ф.VIIа-Т.ф.) превращает ф.Х в сериновую протеиназу ф.Ха . Комплекс тканевой фактор-фактор VII способен активировать как фактор X, так и фактор IX , что в конечном итоге способствует генерации тромбин а [ Boyle, E.M., Verrier, E.D.,ea., (1996) ].
В структуре белка Т.ф. различают три домена: основной, расположенный на поверхности клеточной мембраны, трансмембранный и цитоплазматический. Рецепторными функциями обладает поверхностный домен , содержащий 219 аминокислотных остатков Ser- 1-Glu-219. За 23-членным трансмембранным доменом следует цитоплазматический "хвост", с помощью которого происходит закрепление белка на мембране. Здесь реализуется возможность единственного остатка Cys этого домена образовывать тиоэфирную связь с липидами мембраны (пальмитатом или стеаратом). Определенная роль отводится остаткам алифатических аминокислот, с помощью которых белок встраивается во внутренний слой мембраны, усиливая тем самым "заякоривание" молекулы тканевого фактора. Поверхностный домен гликозилирован по трем остаткам треонина (Thr-13, Thr-126, Thr-139). Он содержит 4 остатка Cys, которые образуют две дисульфидные связи, одну в N-концевой, другую - в С-концевой области домена. Эти связи стабилизируют соответствующие пептидные петли. Показано, что расположенная в С-концевой области дисульфидная связь является функционально значимой, именно ее участие необходимо для проявления кофакторных функций тканевого фактора по отношению к факторам VII и VIIа. На основе анализа первичной структуры, расположения дисульфидных связей и изучения функциональных особенностей, выявлена гомология его с интерферонами Ifn-альфаR и Ifn-гаммаR семейства цитокиновых рецепторов класса II. В системе свертывания крови взаимодействие факторов VII/VIIа с рецептором - кофактором - тканевым фактором, ускоряет в несколько тысяч раз активацию внешнего механизма гемокоагуляции. Это ускорение достигается:
Во-первых, протеолитическим механизмом, инициирующимся при образовании комплекса тканевого фактора с фактором VII/VIIa (VII активным) свертывания крови, в котором тканевый фактор работает как кофактор и модулятор фактора VII/VIIa. Связывание фактора VIIa с тканевым фактором вызывает повышение внутриклеточного Са2+ фосфорилирование активируемых митогеном протеинкиназ ( МАР-киназ) - Erk-1 , Erk-2 , р38 , Jnk и ведет к транскрипции гена Egr-1 (early growth response), индуцируемого обычно цитокинами и факторами роста.
Во-вторых, непротеолитическим механизмом, при котором цитоплазматический домен тканевого фактора сам участвует во внутриклеточной сигнализации, приводящей к
Plasminogen activator, urokinase Обозначения Символы PLAU Entrez Gene … Википедия
I Фибринолитические средства (фибрин + греч. lytikos способный растворять; синоним тромболитические средства) лекарственные средства, способствующие растворению внутрисосудистых тромбов и применяемые при артериальных и венозных тромбозах, а также … Медицинская энциклопедия
- (от Фибрин и греч. lýsis – разложение, растворение) процесс растворения тромбов и сгустков крови, неотъемлемая часть системы гемостаза, всегда сопровождающая процесс свертывания крови и культивирующаяся факторами, принимающими участие в данном… … Википедия
Действующее вещество ›› Алтеплаза* (Alteplase*) Латинское название Actilyse АТХ: ›› B01AD02 Алтеплаза Фармакологическая группа: Фибринолитики Нозологическая классификация (МКБ 10) ›› I21 Острый инфаркт миокарда ›› I74 Эмболия и тромбоз артерий… … Словарь медицинских препаратов
Идиограмма 8 й хромосомы человека 8 я хромосома человека одна из 23 человеческих хромосом, содержащая около 145 миллионов пар оснований, что составляет от 4,5 % до 5 % всего генного материала клетки. На короткое пле … Википедия
ИНФАРКТ ЛЁГКОГО - мед. Инфаркт лёгкого (ИЛ) геморрагическая консолидация паренхимы лёгкого как результат ТЭЛА. Этиология и факторы риска Гиперкоагуляционные состояния Полицитемия Серповидноклеточная анемия Флебит Тромбоз глубоких вен нижних конечностей … Справочник по болезням
ИНФАРКТ МИОКАРДА - мед. Инфаркт миокарда (ИМ) остро возникший очаговый некроз сердечной мышцы вследствие абсолютной или относительной недостаточности коронарного кровотока. Более чем в 95% случаев в основе ИМ лежит атеросклероз коронарных артерий, осложнённый… … Справочник по болезням
ОККЛЮЗИИ АРТЕРИЙ ОСТРЫЕ - мед. Острые окклюзии артерий острое нарушение кровообращения дистальнее места окклюзии артерии эмболом или тромбом. Состояние считают неотложным. Проксимальнее и дистальнее участка окклюзии нарушается нормальный ток крови, что приводит к… … Справочник по болезням
Антонова О.П., Малюгин Б.Э.
Применение рекомбинантного тканевого активатора плазминогена в лечении фибринозного увеита после одномоментной кератопластики и хирургии катаракты (клинический случай)
1 НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава РФФибринозный увеит относится к числу тяжелых осложнений послеоперационного периода хирургии катаракты и кератопластики. Длительное нахождение фибрина в передней камере изменяет и усугубляет течение послеоперационного периода. Возникает опасность токсического и механического воздействия на окружающие ткани, в частности на эндотелиальные клетки трансплантата, а передние синехии, возникающие между иридохрусталиковой диафрагмой и трансплантатом, могут вызвать его (трансплантата) отслоение. Наличие фибринозного выпота в передней камере требует интенсивной местной и системной кортикостероидной терапии, что, в свою очередь, затягивает процесс зрительной реабилитации, при этом длительное лечение может не привести к желаемому конечному результату. Формирование фибринозной зрачковой мембраны ухудшает функциональный результат даже выполненной на высоком техническом уровне операции и вызывает необходимость проведения повторных вмешательств.
Основными препаратами в лечении фибринозного увеита являются фибринолитики и активаторы плазминогена: фибринолизин, стрептодеказа, урокиназа и др. Однако все указанные препараты, кроме урокиназы, являются чужеродными для организма человека белками и нередко вызывают аллергические реакции. Кроме того, в дозах, необходимых для активного фибринолиза, они токсичны для внутренних, а в ряде случаев и для наружных оболочек глаза.
Одним из последних среди препаратов группы тромболитиков в офтальмохирургии является рекомбинантный тканевой активатор плазминогена (рТАП). рТАП является аллогенным ферментом. Его природный аналог находится практически во всех тканях и органах человеческого организма, в том числе и во всех структурах глаза. Поэтому этот фермент не имеет антигенных свойств. Отличительной чертой рТАП является его высокая специфичность к фибрину. Активация плазминогена происходит только на поверхности патологического субстрата (сгустка крови или фибрина), в то время как активации системного фибринолиза при использовании рТАП не происходит.
Фермент алтеплаза, содержащий рекомбинантный тканевой активатор плазминогена, оказывает выраженный тромболитический эффект при таких заболеваниях, как острый инфаркт миокарда, тромбоэмболии легочной артерии и сосудов головного мозга. О результатах применения рТАП в офтальмологии зарубежные ученые впервые сообщили в 80 —е гг. прошлого столетия. Имеется ряд зарубежных работ, посвященных изучению влияния рТАП на внутриглазной фибринолиз в эксперименте и данные о его единичном использовании в клинике. В отечественной литературе первые публикации по данной проблеме относятся к 1995 г.
К настоящему моменту опубликовано немало работ, преимущественно зарубежных исследователей, по применению рТАП в лечении фибринозных увеитов. В ходе ряда исследований изучены вопросы эффективности рТАП при различной патологии глаза, способы его введения, разовые и курсовые дозы препарата, его совместимость с традиционными методами лечения.
В современной отечественной офтальмологии рТАП в лечении послеоперационных осложнений используется крайне редко, что объясняется высокой стоимостью препарата, а следовательно, не является повседневным выбором в борьбе с фибринозным увеитом.
Цель - изучить на собственном клиническом примере эффективность и безопасность применения рекомбинантного тканевого активатора плазминогена в лечении послеоперационного фибринозного увеита.
Материал и методы
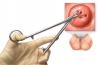
Нами был обследован 1 пациент, 77 лет, с диагнозом эндотелиальной дистрофии роговицы Фукса, сочетанной с катарактой. Острота зрения при поступлении - 0,05, кератопахиметрия - 650 мкм в центральной точке, плотность эндотелиальных клеток определить не удалось. Исходя из вышеуказанных данных было принято решение о проведении одномоментной операции: факоэмульсификация катаракты с имплантацией заднекамерной ИОЛ и задняя автоматизированная послойная кератопластика. На первые сутки послеоперационного периода роговица прозрачна, единичные складки десцеметовой мембраны, передняя камера средней глубины, влага передней камеры прозрачна, радужка структурна, ИОЛ в капсульном мешке, в правильном положении, ПЭК - 1340 кл/мм 2 . В течение первых четырёх суток послеоперационного периода состояние глаза оставалось стабильным. Терапия в послеоперационном периоде была стандартной и включала в себя инстилляции антибиотиков, кортикостероидов, гипотензивных препаратов, кератопротекторов, субконъюнктивальные инъекции кортикостероидов. На пятые сутки после операции при биомикроскопии в передней камере визуализировался фибринозный экссудат, который представлял собой зрачковую мембрану с передними синехиями, фиксированными к краям трансплантата (рис. 1), в связи с чем вышеуказанная терапия была скорректирована: увеличена кратность инстилляций антибиотиков и кортикостероидов в сутки, добавлены инстилляции мидриатиков, НПВС, системное введение кортикостероидов.
Данная терапия проводилась в течение 15 —и дней, но положительной динамики не последовало. Вопрос повторного хирургического вмешательства с целью аспирации фибринозного выпота из передней камеры был отклонен в связи с высоким риском отслойки трансплантата. Было принято решение о применении рекомбинантного тканевого активатора плазминогена («Актилизе» Boehringer Ingelheim Pharma, Германия). На 16 сутки послеоперационного периода рТАП был введен в переднюю камеру в количестве 25 мкгр/мл, 0,2 мл. Расчет представленной дозы препарата был основан на результатах ряда работ зарубежных исследователей.
Результаты
Положительная динамика была отмечена уже в ближайшие часы: к 3 —у часу после введения препарата зрачковая мембрана уменьшилась вдвое, передние синехии, фиксированные к краям трансплантата, полностью отсутствовали. К 8 —у часу после введения рТАП наблюдалось практически полное рассасывание, оставалось незначительное количество фибрина на передней поверхности ИОЛ. На следующие сутки по данным OCT Visante на передней поверхности ИОЛ отмечалось сохранение зрачковой мембраны, размеры которой в сагиттальной плоскости составили 0,21 —0,28 мм. Для оценки состояния монослоя эндотелиальных клеток трансплантата после введения рТАП в переднюю камеру был проведен подсчет ПЭК, который составил 1290 кл/мм 2 , острота зрения - 0,3. На 7 —е сутки после введения рТАП при биомикроскопии фибринозная мембрана наблюдалась на передней поверхности ИОЛ у зрачкового края радужки, по данным OCT Visante размеры остаточного фибрина были следующие: в сагиттальной плоскости - 0,09 мм, во фронтальной плоскости - 0,54 мм. ПЭК - 1310 кл/мм 2 , острота зрения оставалась стабильной - 0,3. Спустя 1 мес. после введения рТАП наступило полное разрешение фибринозного процесса в передней камере, ПЭК - 1280 кл/мм 2 , острота зрения - 0,4. Стоит отметить, что в течение всего послеоперационного периода, сопровождавшегося вышеизложенной терапией, введением рТАП в переднюю камеру, трансплантат оставался прозрачным, состоятельным, отмечалось его полное прилегание к задним слоям стромы реципиента (рис. 2).
Выводы
Исходя из вышеизложенного клинического случая, можно сделать заключение, что процесс рассасывания фибрина в передней камере при однократном внутрикамерном введении рТАП многократно ускоряется. Таким образом, основываясь на собственном клиническом опыте, мы можем утверждать, что применение рекомбинантного тканевого активатора плазминогена является безопасной и эффективной альтернативой в устранении послеоперационных фибринозных мембран. Отсутствие побочных реакций и негативного влияния на роговичный эндотелий, полное разрешение фибринозного процесса под действием рТАП устраняет необходимость проведения повторных хирургических вмешательств, что, в свою очередь, снижает риск дислокации трансплантата и обеспечивает ускоренную зрительную реабилитацию пациента. К сожалению, высокая стоимость данного препарата исключает в большинстве случаев его использование в клинике.
Страница источника: 9
Главный компонент плазменной фибринолитической системы. Активаторы плазминогена с точки зрения их физиологического и патофизиологического значения могут быть естественного (физиологического) и бактериального происхождения.
Физиологические активаторы плазминогена
Аналогично системе свертывания, различают два пути активации плазминогена - внутренний и внешний.
Внутренний механизм запускается теми же факторами, которые инициируют свертывание крови, а именно фактором XIIa (активированный фактор Хагемана), который, взаимодействуя с прекалликреином и высокомолекулярным кининогеном плазмы, активирует плазминоген.
Контакт плазмы с инородной поверхностью через фактор XII, активирующий свертывание крови, одновременно вызывает и активацию фибринолиза. При этом в процессе активации фактора XII особый проактиватор плазминогена плазмы, идентичный прекалликреину (фактору Флетчера), переводится в активатор плазминогена, который активирует плазминоген в плазмин.
Далее оказалось, что под воздействием протеолитических ферментов на фактор XII образуются преальбуминовые фрагменты. Они, как прокоагулянты, менее активны, чем активированный фактор XII, но обладают двумя другими видами активности: возбуждают фибринолиз и образование кининов. Фрагменты фактора XII превращают проактиваторы в активатор плазминогена. Прямую активацию плазминогена вызывает калликреин. Однако в норме в крови человека свободного калликреина нет: он находится в неактивном состоянии или в комплексе с ингибиторами, поэтому активация плазминогена калликреином возможна лишь в случае значительного повышения активности кининовой системы.
Таким образом, внутренний путь фибринолиза обеспечивает активацию плазминовой системы не вслед за свертыванием крови, а одновременно с ним. Он работает по «замкнутому циклу», так как образующиеся первые порции калликреина и плазмина подвергают протеолизу фактор XII, отщепляя фрагменты, под влиянием которых нарастает трансформация прекалликреина в калликреин.
Активация по внешнему пути осуществляется, в первую очередь, за счет тканевого активатора плазминогена (ТАП), который синтезируется в клетках эндотелия, выстилающего сосуды. Идентичные или очень сходные с ним активаторы содержатся во многих тканях и жидкостях организма. Секреция тканевого активатора плазминогена из клеток эндотелия осуществляется постоянно и усиливается под влиянием разных стимулов: тромбина, ряда гормонов и лекарственных препаратов (адреналин, вазопрессин и его аналоги, никотиновая кислота), стресса, шока, тканевой гипоксии, хирургической травмы. Плазминоген и тканевой активатор плазминогена обладают выраженным сродством к фибрину. При появлении фибрина плазминоген и его активатор связываются с ним с образованием тройного комплекса (фибрин-плазминоген- тканевой активатор плазминогена), все составляющие которого расположены таким образом, что происходит эффективная активация плазминогена. В результате плазмин образуется прямо на поверхности фибрина; последний далее подвергается протеолитической деградации.
Вторым природным активатором плазминогена является урокиназа, синтезируемая почечным эпителием, которая в отличие от тканевого активатора не имеет сродства к фибрину. Активация плазминогена при этом происходит на специфических рецепторах поверхности клеток эндотелия и ряда форменных элементов крови, непосредственно участвующих в образовании тромба. В норме уровень урокиназы в плазме в несколько раз выше уровня тканевого активатора плазминогена; имеются сообщения о важной роли урокиназы в заживлении поврежденного эндотелия.
Как тканевой активатор плазминогена, так и урокиназа синтезируются в настоящее время методами рекомбинантной ДНК и используются в качестве лекарственных препаратов.
Бактериальные активаторы фибринолиза
К бактериальным активаторам фибринолиза относятся стрептокиназа и стафилокиназа. Так как человек в течение жизни часто болеет явными или скрытыми стрептококковыми и стафилококковыми заболеваниями, то есть возможность попадания стрептокиназы и стафилокиназы в кровь.
Стрептокиназа – мощный специфический активатор фибринолиза. Продуцируется она гемолитическим стрептококком групп A, C.
Стрептокиназа является непрямым активатором плазминогена. Она действует на проактиватор плазминогена, переводит его в активатор, который активирует плазминоген в плазмин.
Реакция между стрептокиназой и проактиватором плазминогена проходит в две стадии: в первой из проактиватора I образуется проактиватор II, во второй проактиватор II превращается в активатор, который и активирует плазминоген.
Активаторы плазминогена (АП)- высокоспецифичные сериновые протеазы регуляторного типа. Известно много АП, выделенных из крови и других биологических жидкостей и тканей человека. Они разделяются на физиологические активаторы, которые в зависимости от источника получения могут быть тканевыми (органными), сосудистыми (тканевый активатор плазминогена), плазменными, кровяными, мочевыми (урокиназа) и т.д. и выделяемые из микроорганизмов (стрептокиназа). Практически все АП образуются в виде проферментов (проактиваторов плазминогена).
Активирование плазминогена может быть:
внешним – под действием активаторов тканей, крови, сосудистой стенки, которые высвобождаются в кровь под влиянием различных факторов;
внутренним – при участии белков плазмы – фактора Хагемана, прекалликреина, высокомолекулярного кининогена;
экзогенным – после введения в организм активаторов плазминогена (стрептокиназа и созданные на ее основе препараты, урокиназа, комплекс стрептокиназа – лиз-плазминоген; тканевый активатор плазминогена, получаемый методом генной инженерии, и другие препараты) с терапевтической целью.
Внутренний путь активации фибринолиза (Хагеманзависимый фибринолиз) инициируется фактором Хагемана (фактор ХП) плазмы крови. После фиксации фактора XII и комплекса высокомолекулярный кининоген-прекалликреин на чужеродной или измененной поверхности (коллаген или др.), путем ограниченного протеолиза происходит образование активного калликреина, который катализирует превращение фактора XII в его активную форму –фактор XIIa. Последний способствует превращению плазминогена в плазмин. Свободный калликреин также является прямым активатором плазминогена.
Хагеманзависимый фибринолиз активируется одновременно с включением каскада реакций образования протромбиназы по внутреннему механизму и его основное назначение – очищение сосудистого русла от фибриновых сгустков, образующихся в процессе внутрисосудистого свертывания крови. В активировании Хагеманзависимого фибринолиза могут принимать участие АПГ, содержащиеся в форменных элементах крови.
Внешний путь активации плазминогена – ведущий путь при повреждении тканей, стимулируется различными тканевыми активаторами плазминогена. Важнейший из них – тканевый активатор плазминогена (тАП), которыйсинтезируется эндотелиальными клетками кровеносных сосудов и по мере надобности расходуется на активацию фибринолиза (рис.13.15).
Рис.13.15.Схема строения тАП
Его мол. масса 70 кДа, имеет один домен, структурно подобный ЭФР, 2 крингла и пальцевидный домен, что напоминает структуру плазмина. Секреция тАП эндотелиоцитами происходит не только при тромбозе сосудов, но и при сжатии манжеткой, при физических нагрузках, под влиянием вазоактивных веществ (адреналина, норадреналина) и некоторых лекарственных препаратов. Этот активатор и его ингибиторы обеспечивают постоянно действующую регуляцию фибринолитической активности. На долю тАП приходится 85 % внешней фибринолитической активности крови.
По структуре и механизму действия к тАП близки содержащиеся в разных тканях другие активаторы фибринолиза, которые поступают в кровь при повреждении тканей (травмы, деструкция тканей, акушерская патология и др.). Особое место среди тканевых (органных) факторов фибринолиза занимает продуцируемая почечной тканью и эпителием мочевыводящих путей урокиназа, большая часть которой выделяется с мочой. Урокиназа обеспечивает около 10-15 % внешней фибринолитической активности крови. Она способна проникать внутрь тромба и там катализировать превращение плазминогена в плазмин, разрушая таким образом тромб не только снаружи, но и изнутри.
Кровяные активаторы плазминогена содержатся в клетках крови (эритроцитах, тромбоцитах и лейкоцитах) и высвобождаются при их активации и разрушении, а также при тромбообразовании, особенно индуцированном эндотоксином.
Из экзогенных активаторов наиболее изучена стрептокиназа – неферментный белок (мол. м асса 47 кДа), продуцируемый β-гемолитическим стрептококком и в обычных условиях отсутствующий в крови. Стрептокиназа, как и деказа, целиаза, авелизин и другие, не обладают самостоятельной ферментативной активностью по отношению к плазмину, но, соединяясь с плазминогеном, они образуют комплекс, инициирующий превращение плазминогена в плазмин. Таким образом, стрептокиназа активирует плазминоген, связанный с фибриновым сгустком, также, как и плазминоген в растворимой фазе, что сопровождается образованием свободного плазмина. При стрептококковой инфекции возможно образование стрептокиназы в большом количестве, что может приводить к усиленному фибринолизу (фибриногенолизу) и развитию геморрагического диатеза. Превращение плазминогена в плазмин, так же, как и сам процесс лизиса фибриновых сгустков, происходит на поверхности данных сгустков. Сгустки фибрина избирательно адсорбируют и удерживают плазминоген. Богатые лизинами участки (ЛУ), расположенные в центральной части молекулы фибрин(оген)а, связываются с доменами- кринглами плазминогена, при этом одна молекула плазминогена связывается с несколькими молекулами фибрин(оген)а., что позволяет молекуле плазмина действовать на новые интактные молекулы фибрина, оставаясь связанной с субстратом и избегая при этом перехода в раствор и инактивации при контакте с a2-антиплазмином. Вместе с плазминогеном сгусток фибрина специфически связывает активаторы плазминогена. Тканевые активаторы плазминогена имеют низкую каталитическую активность в отсутствие фибрина и активируются при связывании с ним. Активаторы тканевого типа, за исключением урокиназы, имеют более высокое сродство к фибрину в сравнении с фибриногеном, что объясняет преимущественный фибринолиз и в очень слабой степени фибриногенолиз. Одновременное присутствие плазминогена и его активаторов на поверхности фибрина обеспечивает естественное формирование плазмина, и фибрин расщепляется на растворимые фрагменты, получившие название продукты деградации фибрина (ПДФ).
Различные ПДФ проявляют антикоагулянтные, антиполимеризационные, антиагрегационные и другие свойства. Определение ранних и поздних ПДФ проводят для ранней диагностики изменений фибринолитической активности, стадий ДВС-синдромов, дифференциации первичного и вторичного фибринолиза. Ни плазмин, ни активатор плазминогена не связываются с ПДФ и по мере растворения сгустка выходят в плазму, где инактивируются естественными ингибиторами.