ඇල්කේන වල ව්යුහය
ඇල්කේන යනු හයිඩ්රොකාබන වන අතර ඒවායේ අණු වල පරමාණු තනි බන්ධන මගින් සම්බන්ධ කර ඇති අතර ඒවා සාමාන්ය සූත්රයට අනුරූප වේ. C n H 2n+2. ඇල්කේන අණු වල, සියලුම කාබන් පරමාණු රාජ්යයේ පවතී sp 3 - දෙමුහුන්කරණය.
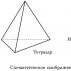
මෙයින් අදහස් කරන්නේ කාබන් පරමාණුවේ දෙමුහුන් කාක්ෂික හතරම හැඩයෙන්, ශක්තියෙන් සමාන වන අතර සමපාර්ශ්වික ත්රිකෝණාකාර පිරමීඩයක කොන් දෙසට යොමු කර ඇති බවයි. tetrahedron. කක්ෂ අතර කෝණ 109° 28′ වේ. තනි කාබන්-කාබන් බන්ධනයක් වටා පාහේ නිදහස් භ්රමණය විය හැකි අතර, ඇල්කේන අණු ටෙට්රාහෙඩ්රල් (109° 28′) ට ආසන්න කාබන් පරමාණුවල කෝණ සහිත විවිධ හැඩයන් ගත හැකිය, උදාහරණයක් ලෙස, n-පෙන්ටේන් අණුවේ.

විශේෂයෙන්ම ඇල්කේන අණු වල බන්ධන සිහිපත් කිරීම වටී. සංතෘප්ත හයිඩ්රොකාබන අණු වල සියලුම බන්ධන තනි වේ. අතිච්ඡාදනය සිදුවන්නේ පරමාණුවල න්යෂ්ටීන් සම්බන්ධ කරන අක්ෂය ඔස්සේය, එනම් එය σ බැඳුම්කර. කාබන්-කාබන් බන්ධන ධ්රැවීය නොවන අතර දුර්වල ලෙස ධ්රැවීකරණය වේ. ඇල්කේන වල C-C බන්ධනයේ දිග 0.154 nm (1.54 10 10 m) වේ. C-H බන්ධන තරමක් කෙටි වේ. ඉලෙක්ට්රෝන ඝනත්වය වැඩි විද්යුත් සෘණ කාබන් පරමාණුව දෙසට තරමක් මාරු වේ, එනම් C-H බන්ධනය වේ. දුර්වල ධ්රැවීය.
මීතේන් සමජාතීය ශ්රේණිය
සමලිංගිකයන්- ව්යුහයෙන් හා ගුණයෙන් සමාන සහ වෙනස් වන ද්රව්ය CH කණ්ඩායම් එකක් හෝ කිහිපයක් 2 .


සන්තෘප්ත හයිඩ්රොකාබනමීතේන් සමජාතීය ශ්රේණිය සාදයි.
ඇල්කේනවල සමාවයවිකතාව සහ නාමකරණය
ඇල්කේන ඊනියා මගින් සංලක්ෂිත වේ ව්යුහාත්මක සමාවයවිකතාව. කාබන් ඇටසැකිල්ලේ ව්යුහය තුළ ව්යුහාත්මක සමාවයවික එකිනෙකට වෙනස් වේ. ව්යුහාත්මක සමාවයවික මගින් සංලක්ෂිත වන සරලම ඇල්කේනය බියුටේන් වේ.

ඇල්කේන සඳහා මූලික නාමකරණය වඩාත් විස්තරාත්මකව සලකා බලමු IUPAC.
1. ප්රධාන පරිපථ තේරීම. හයිඩ්රොකාබනයක නම ගොඩනැගීම ආරම්භ වන්නේ ප්රධාන දාමයේ නිර්වචනයෙනි - අණුවේ ඇති කාබන් පරමාණු වල දිගම දාමය, එය එහි පදනමයි.
2. ප්රධාන දාම පරමාණු ගණන කිරීම. ප්රධාන දාමයේ පරමාණුවලට සංඛ්යා පවරා ඇත. ප්රධාන දාමයේ පරමාණු අංකනය කිරීම ආරම්භ වන්නේ ආදේශකය ආසන්නතම කෙළවරේ සිටය (ව්යුහයන් A, B). ආදේශක දාමයේ කෙළවරේ සිට සමාන දුරකින් පිහිටා තිබේ නම්, අංකනය ආරම්භ වන්නේ ඒවායින් වැඩි ගණනක් ඇති කෙළවරේ සිටය (ව්යුහය B). විවිධ ආදේශක දාමයේ කෙළවරේ සිට සමාන දුරකින් පිහිටා තිබේ නම්, අංකනය ආරම්භ වන්නේ ජ්යෙෂ්ඨ එක ආසන්නතම (ව්යුහය ඩී). හයිඩ්රොකාබන් ආදේශකවල ජ්යෙෂ්ඨත්වය තීරණය වන්නේ ඒවායේ නම ආරම්භ වන අකුර හෝඩියේ දිස්වන අනුපිළිවෙල අනුව ය: මෙතිල් (-CH 3), පසුව ප්රොපයිල් (-CH 2 -CH 2 -CH 3), එතිල් (-CH 2 -CH 3) ආදිය.
ආදේශකයේ නම සෑදී ඇත්තේ -ane යන උපසර්ගය වෙනුවට -yl උපසර්ගය සමඟ අනුරූප ඇල්කේන නාමයෙන් බව කරුණාවෙන් සලකන්න.
3. නම ගොඩනැගීම. නමේ ආරම්භයේ දී, සංඛ්යා දක්වා ඇත - ආදේශක පිහිටා ඇති කාබන් පරමාණුවල සංඛ්යා. දී ඇති පරමාණුවක ආදේශක කිහිපයක් තිබේ නම්, නමේ ඇති අනුරූප අංකය කොමාවකින් (2,2-) වෙන් කර දෙවරක් පුනරාවර්තනය වේ. අංකයට පසුව, ආදේශක ගණන (ඩි - දෙක, තුන - තුන, ටෙට්රා - හතර, පෙන්ටා - පහ) සහ ආදේශකයේ නම (මෙතිල්, එතිල්, ප්රොපයිල්) දැක්වීමට හයිෆන් භාවිතා වේ. එවිට, හිස් හෝ හයිෆන්ස් නොමැතිව, ප්රධාන දාමයේ නම. ප්රධාන දාමය හයිඩ්රොකාබන් ලෙස හැඳින්වේ - සමජාතීය මීතේන් ශ්රේණියේ (මීතේන්, ඊතේන්, ප්රොපේන්, ආදිය) සාමාජිකයෙකි.




ඉහත දක්වා ඇති ව්යුහාත්මක සූත්ර ඇති ද්රව්යවල නම් පහත පරිදි වේ:
ව්යුහය A: 2-මෙතිල්ප්රොපේන්;
ව්යුහය B: 3-එතිල්හෙක්සන්;
ව්යුහය B: 2,2,4-ට්රයිමෙතිල්පෙන්ටේන්;
ව්යුහය D: 2-මෙතිල් 4-එතිල්හෙක්සේන්.
අණු වල සංතෘප්ත හයිඩ්රොකාබන නොමැති වීම ධ්රැවීය බන්ධනඔවුන් වෙත යොමු කරයි ජලයේ දුර්වල ලෙස ද්රාව්ය වේ, ආරෝපිත අංශු (අයන) සමඟ අන්තර් ක්රියා නොකරන්න. ඇල්කේන සඳහා වඩාත්ම ලාක්ෂණික ප්රතික්රියා ඇතුළත් වේ නිදහස් රැඩිකලුන්.
ඇල්කේනවල භෞතික ගුණාංග
මීතේන් සමජාතීය ශ්රේණියේ පළමු නියෝජිතයන් හතර දෙනා වේ වායූන්. ඒවායින් සරලම වන්නේ මීතේන් - අවර්ණ, රස සහ ගන්ධ රහිත වායුවකි ("ගෑස්" වල සුවඳ, ඔබ එය ගඳ ගන්නා විට, ඔබ 04 ඇමතීමට අවශ්ය වේ, එය තීරණය වන්නේ මර්කැප්ටන් වල සුවඳෙනි - භාවිතා කරන මීතේන් වලට විශේෂයෙන් එකතු කරන ලද සල්ෆර් අඩංගු සංයෝග. ගෘහස්ත සහ කාර්මික ගෑස් උපකරණවල , ඔවුන් අසල පිහිටා ඇති පුද්ගලයින්ට සුවඳින් කාන්දු වීම හඳුනාගත හැකිය).
සිට සංයුතියේ හයිඩ්රොකාබන සමග 5 එන් 12 කලින් සමග 15 එන් 32 - දියර; බර හයිඩ්රොකාබන ඝන ද්රව්ය වේ. කාබන් දාමයේ දිග වැඩි වීමත් සමඟ ඇල්කේනවල තාපාංක හා ද්රවාංකය ක්රමයෙන් වැඩි වේ. සියලුම හයිඩ්රොකාබන ජලයේ දුර්වල ලෙස ද්රාව්ය වේ; ද්රව හයිඩ්රොකාබන පොදු කාබනික ද්රාවක වේ.


ඇල්කේනවල රසායනික ගුණ
ආදේශන ප්රතික්රියා.
ඇල්කේන සඳහා වඩාත් ලාක්ෂණික ප්රතික්රියා වේ නිදහස් රැඩිකල් ආදේශනය, හයිඩ්රජන් පරමාණුවක් හැලජන් පරමාණුවකින් හෝ යම් කණ්ඩායමකින් ප්රතිස්ථාපනය වේ.
අපි ලාක්ෂණික සමීකරණ ඉදිරිපත් කරමු හැලජනන ප්රතික්රියා:
අතිරික්ත හැලජන් නම්, ක්ලෝරීනකරණය තවදුරටත් ඉදිරියට යා හැක, සියලුම හයිඩ්රජන් පරමාණු ක්ලෝරීන් සමඟ සම්පුර්ණයෙන්ම ප්රතිස්ථාපනය කිරීම දක්වා:

ප්රතිඵලයක් වශයෙන් ද්රව්ය කාබනික සංස්ලේෂණයන්හි ද්රාවණ සහ ආරම්භක ද්රව්ය ලෙස බහුලව භාවිතා වේ.
විජලනය කිරීමේ ප්රතික්රියාව(හයිඩ්රජන් වියුක්ත කිරීම).
ඇල්කේන උත්ප්රේරකයක් (Pt, Ni, Al 2 O 3, Cr 2 O 3) හරහා ඉහළ උෂ්ණත්වවලදී (400-600 ° C) ගමන් කරන විට, හයිඩ්රජන් අණුවක් ඉවත් කරනු ලැබේ. ඇල්කේන්:
කාබන් දාමයේ විනාශය සමඟ ප්රතික්රියා. සියලුම සංතෘප්ත හයිඩ්රොකාබන පිච්චෙනවාකාබන් ඩයොක්සයිඩ් සහ ජලය සෑදීමත් සමඟ. වායුමය හයිඩ්රොකාබන යම් ප්රමාණයකින් වාතය සමඟ මිශ්ර වී පුපුරා යා හැක.
1. සංතෘප්ත හයිඩ්රොකාබන දහනය කිරීමයනු නිදහස් රැඩිකල් බාහිර තාප ප්රතික්රියාවකි, එය ඇල්කේන ඉන්ධන ලෙස භාවිතා කිරීමේදී ඉතා වැදගත් වේ:
සාමාන්යයෙන්, ඇල්කේනවල දහන ප්රතික්රියාව පහත පරිදි ලිවිය හැකිය:
2. හයිඩ්රොකාබන තාප බෙදීම.
අනුව ක්රියාවලිය ඉදිරියට යයි නිදහස් රැඩිකල් යාන්ත්රණය. උෂ්ණත්වය වැඩිවීම කාබන්-කාබන් බන්ධනයේ සමජාතීය බෙදීම් සහ නිදහස් රැඩිකලුන් සෑදීමට හේතු වේ.
මෙම රැඩිකලුන් එකිනෙකා සමඟ අන්තර් ක්රියා කරමින් හයිඩ්රජන් පරමාණුවක් හුවමාරු කර අණුවක් සාදයි ඇල්කේන සහ ඇල්කේන අණු:
කාර්මික ක්රියාවලියට යටින් පවතින තාප වියෝජන ප්රතික්රියා - හයිඩ්රොකාබන් ඉරිතැලීම. මෙම ක්රියාවලිය තෙල් පිරිපහදු කිරීමේ වැදගත්ම අදියරයි.
3. පයිෙරොලිසිස්. මීතේන් 1000 ° C උෂ්ණත්වයකට රත් කළ විට, මීතේන් pyrolysis- සරල ද්රව්ය බවට වියෝජනය:
1500 ° C උෂ්ණත්වයකට රත් වූ විට, සෑදීම ඇසිටිලීන්:
4. සමාවයවිකීකරණය. රේඛීය හයිඩ්රොකාබන සමාවයවිකීකරණ උත්ප්රේරකයක් (ඇලුමිනියම් ක්ලෝරයිඩ්) සමඟ රත් කළ විට ශාඛා කාබන් ඇටසැකිල්ල:

5. ඇරෝමැටේෂන්. දාමයේ කාබන් පරමාණු හයක් හෝ වැඩි ගණනක් සහිත ඇල්කේන බෙන්සීන් සහ එහි ව්යුත්පන්න සෑදීමට උත්ප්රේරකයක් ඉදිරියේ චක්රීය වේ:

ඇල්කේන අණු වල සියලුම කාබන් පරමාණු sp 3 දෙමුහුන් තත්වයක පවතින බැවින් ඇල්කේන නිදහස් රැඩිකල් යාන්ත්රණයට අනුව ක්රියා කරන ප්රතික්රියා වලට ඇතුල් වේ. මෙම ද්රව්යවල අණු ගොඩනගා ඇත්තේ සහසංයුජ ධ්රැවීය නොවන C-C (කාබන්-කාබන්) බන්ධන සහ දුර්වල ධ්රැවීය C-H (කාබන්-හයිඩ්රජන්) බන්ධන භාවිතා කරමිනි. ඉලෙක්ට්රෝන ඝනත්වය වැඩි වූ හෝ අඩු වූ ප්රදේශ හෝ පහසුවෙන් ධ්රැවීකරණය කළ හැකි බන්ධන ඇති ප්රදේශ ඒවායේ අඩංගු නොවේ, එනම් බාහිර සාධකවල බලපෑම යටතේ ඉලෙක්ට්රෝන ඝනත්වය මාරු විය හැකි එවැනි බන්ධන (අයනවල විද්යුත් ස්ථිතික ක්ෂේත්ර). එහි ප්රතිඵලයක් වශයෙන්, ඇල්කේන ආරෝපිත අංශු සමඟ ප්රතික්රියා නොකරනු ඇත, මන්ද ඇල්කේන අණු වල බන්ධන විෂම විච්ඡේදක යාන්ත්රණය මගින් බිඳී නොයයි.
අරමුණ: ව්යුහාත්මක ලක්ෂණ, සමජාතීය ශ්රේණි, සමාවයවිකතාව, ඇල්කේන නාමකරණය සහ ඒවා සකස් කිරීම පිළිබඳව සිසුන් හුරු කරවීම.
- අධ්යාපනික. ඇල්කේන පිළිබඳ මූලික අවබෝධයක් ලබා ගන්න (සාමාන්ය සූත්රය, ඇල්කේනවල සමජාතීය ශ්රේණි, ඒවායේ සංයුතිය සහ ව්යුහය, යෙදුම්).
- සංවර්ධනාත්මක. සමාවයවිකතාව පිළිබඳ පූර්ව අවබෝධය සහ IUPAC නාමකරණය භාවිතයෙන් නම් ලබා දීමේ හැකියාව වර්ධනය කරන්න.
- අධ්යාපනික. රසායන විද්යාව හැදෑරීමට පෙළඹවීම වැඩි කිරීමට උනන්දුවෙන් ක්රියාශීලීව ඉගෙනීමට ඇති ආශාව වර්ධනය කිරීම.
උපකරණ: පරිගණකය, බහුමාධ්ය ප්රක්ෂේපකය, තිරය.
වැඩ ප්රගතිය
I. සංවිධානාත්මක මොහොත.
II. අභිප්රේරණ අවහිරය.
ගුරු. අපි දිගටම කාබනික රසායනය අධ්යයනය කරනවා. වසර 160ක් ආපස්සට, හොඳ පැරණි එංගලන්තයට යන්න මම ඔබට ආරාධනා කරනවා (ඉදිරිපත් කිරීම.ස්ලයිඩය 1) .
1848 15 හැවිරිදි හැනා ග්රීන්ර් කුඩා සැත්කමක් අතරතුර නිව්කාසල්හිදී මිය ගියේය. ශල්යකර්මය සිදුකළ වෛද්ය Meggison මරණ පරීක්ෂණයේදී කරුණු දැක්වූයේ මෙසේය. “මම රෝගියාව පුටුවක වාඩි කර මෙම ද්රව්ය තේ හැන්දකින් තෙත් කළ ලේන්සුවක් ඇගේ නාසයට ගෙනාවෙමි. හැනා හුස්ම දෙකක් ගත්තා. මිනිත්තුවකට පසු, මම මගේ සහායකයාට මෙහෙයුම ආරම්භ කරන ලෙස ඉල්ලා සිටියෙමි. තවත් විනාඩියකට පසු, මම ඇගේ දෑස් මදක් විවර කළෙමි, ඒවා විවෘතව පැවතුනි, ස්ක්ලෙරා වල භාජන රුධිරයෙන් පිරී තිබුණි, ඇගේ තොල් සහ මුහුණ ඉතා සුදු පැහැයට හැරුණි. නහර වලින් ලේ ගැලීම සිදු කිරීමට මම තීරණය කළ නමුත් මට ලේ හැන්දකට වඩා ලැබුණේ නැත. මම හිතන්නේ ඇය ලේ වැගිරවීමට මගේ උත්සාහයට පෙර මිය ගියාය. මෙම ද්රව්යය පළමු ආශ්වාස කිරීමේ මොහොතේ සිට මරණය දක්වා මිනිත්තු තුනකට වඩා ගත නොවීය. හැනාගේ මරණයට හේතුව කුමක්ද යන්න තවමත් අභිරහසක්. ඔබ සිතන්නේ අප කතා කරන්නේ කුමන ද්රව්යයක් ගැනද? ( සියලුම යෝජනා අසනු ලැබේ.)ක්ලෝරෝෆෝම්. සූත්රය සොයා ගන්න. (පරිශීලන පොතක්, අන්තර්ජාලය භාවිතා කරන්න.)CH3Cl.මෙම ද්රව්යය CH4 හි ව්යුත්පන්නයකි. මෙම ද්රව්යය අයත් වන්නේ කුමන පන්තියටද? ඇල්කේනස්.(සිසුන් පාඩමේ මාතෘකාව ඔවුන්ගේ සටහන් පොත්වල ලියා ඇත.)අපි අධ්යයනය කරන සියලුම කාබනික ද්රව්යවල පළමු පන්තිය වන ඇල්කේනස්. එබැවින්, සියලුම කාබනික ද්රව්ය පන්ති අධ්යයනය කරන සැලැස්මක් මම ඔබට යෝජනා කරමි.
1. අර්ථ දැක්වීම. සූත්රය. සංයෝගය.
2. ව්යුහය.
3. සමජාතීය මාලාව. නාමකරණය.
4. සමාවයවිකතා වර්ග.
5. ලබා ගැනීමේ ක්රම.
6. භෞතික ගුණාංග.
7. රසායනික ගුණ.
8. අයදුම්පත.
(ලකුණු 1-5 පළමු පාඩමේදීත්, 6-8 දෙවන පාඩමේදීත් අධ්යයනය කෙරේ.)
III. ඉලක්ක සැකසීම.
සැලැස්මේ පළමු කරුණු 5 දෙස බලා පාඩමේ අරමුණ සකස් කරන්න.
IV. කාර්ය සාධන වාරණ.
ගුරුවරයා: ඔබ සිතන්නේ කුමක්ද, අපි ඇල්කේන අධ්යයනය කළ යුත්තේ ඇයි? පෙළ පොත p.79 විවෘත කරන්න. ඇල්කේන භාවිතා කිරීමේ යෝජනා ක්රමය සලකා බලන්න. ඔබට පෙනෙන පරිදි, ඇල්කේන පුළුල් පරාසයක භාවිතයන් ඇත. එමනිසා, මෙම ද්රව්යවල ව්යුහය, ගුණාංග සහ නිෂ්පාදනය පිළිබඳව සෑම පුද්ගලයෙකුම දැන සිටිය යුතු යැයි මම සිතමි.
ගුරු.ඔබ ඇල්කේන ගැන දන්නේ මොනවාද? (සියලු ශිෂ්ය පිළිතුරු පුවරුවේ ලියා ඇත. සාමාන්ය සූත්රය CnH2n+2; C-C තනි බැඳුම්කර, -an)සටහන් මත පදනම්ව, සිසුන් ඇල්කේන පිළිබඳ පොදු විස්තරයක් ලබා දෙයි. ස්ලයිඩය පරීක්ෂා කරන්න (විනිවිදකය 2).
කාබනික ද්රව්යවල සූත්ර අතර, ඇල්කේනවල සූත්ර තෝරන්න ( සිමියුලේටරය සමඟ වැඩ කිරීම) (ඇමුණුම 1). ගුරුවරයා විසින් පුවරුවේ සිසුන් විසින් සොයාගත් සියලුම සූත්ර තීරුවක ලියයි. CH2 කාණ්ඩ එකක් හෝ කිහිපයක් මගින් එකිනෙකට වෙනස් වන ද්රව්ය ගණනාවක් සෑදී ඇත. සමජාතීය මාලාවක් පිහිටුවා ඇති බව සිසුන් නිගමනය කරයි (විනිවිදකය 3).
ඇල්කේන වල නාමකරණය මතක තබා ගන්න.
ගුරු.මීතේන් අණුවක උදාහරණය භාවිතා කරමින් අපි ඇල්කේනවල ව්යුහය අධ්යයනය කරමු . කොටස බැලීමෙන් පසු ප්රශ්න වලට පිළිතුරු දෙන්න: - දෙමුහුන්කරණය යනු කුමක්ද? ? - ඇල්කේන වලට ඇත්තේ කුමන ආකාරයේ දෙමුහුන්කරණයක්ද? – කක්ෂ අතර කෝණ? C-Link එකේ දිග? (මීතේන් අණුවේ ව්යුහය බලන්න (N 132051) TsOR). ( සමඟ වැඩ කරන්න ස්ලයිඩය 4).
ගුරු. සමාවයවිකතාව යනු කුමක්ද සහ කාබනික ද්රව්යවල ලක්ෂණ වන්නේ කුමන ආකාරයේ සමාවයවිකතාවද යන්න මතක තබා ගනිමු (විනිවිදකය 5).
apcans හි ලක්ෂණය ලෙස ඔබ සිතන්නේ කුමන ආකාරයේ සමාවයවිකතාවද? ඉවත් කිරීමේ ක්රමය අනුව, ඇල්කේන එක් ආකාරයක සමාවයවිකතාවකින් සංලක්ෂිත බව සිසුන් තහවුරු කරයි. කාබන් ඇටසැකිල්ලේ සමාවයවිකතාව. එක් ශිෂ්යයෙක් C5H12 සූත්රය සහිත ද්රව්යයක් සඳහා සමාවයවික සෑදීමට මණ්ඩලයට පැමිණ, IUPAC නාමකරණය භාවිතයෙන් ඔවුන්ට නම් ලබා දෙයි. (ශ්රේණිගත කරයි). අවශ්ය නම්, ප්රතිලෝම කාර්යය සම්පූර්ණ කිරීම සඳහා ශිෂ්යයෙකුට මණ්ඩලයට ආරාධනා කරනු ලැබේ.
ව්යායාම කරන්න. පහත සඳහන් ද්රව්ය සඳහා ව්යුහාත්මක සූත්ර සාදන්න.
a) 2,3 ඩිමෙතිල්පෙන්ටේන්; ආ) 2.5 ඩිමෙතිල්හෙක්සන්; ඈ) 3 මෙතිල්-3 එතිල්හෙප්ටේන් (ශ්රේණියක් ලබා ගනී).
ගුරු. ඇල්කේන බහුලව භාවිතා වන බැවින්, ඒවා සකස් කිරීම සඳහා ක්රම අධ්යයනය කිරීම අවශ්ය වේ . (පිළිගැනීම අධ්යයනය කරනු ලබන්නේ පෙළපොත පි. 70 භාවිතා කරමිනි. ප්රතික්රියා විනිවිදක 6 සිට සටහන් පොතක ලියා ඇත)
V. පාලන සහ ඇගයීම් වාරණ.
පරීක්ෂණයක ස්වරූපයෙන් ස්වාධීන කාර්යයක් පිරිනමනු ලැබේ (ඇමුණුම 2). (අන්යෝන්ය පරීක්ෂාවක් ඇති අතර ශ්රේණි ලබා දෙනු ලැබේ).පාඩම් සැලැස්ම වෙත ආපසු යන්න, ලකුණු 1-5 බලන්න, ප්රශ්නවලට පිළිතුරු දෙන්න
- අපි අපේ ඉලක්කය සපුරා ගත්තාද?
- පාඩමෙන් ඔබ ඉගෙන ගත් අලුත් මොනවාද?
- රසවත් වූයේ කුමක්ද?
ඇල්කේන යනු හයිඩ්රජන් පරමාණු මගින් සරල බන්ධන හරහා සියලුම කාබන් පරමාණු අල්ලා ගන්නා අණු වල සංතෘප්ත හයිඩ්රොකාබන වේ. එබැවින්, මීතේන් ශ්රේණියේ සමජාතීය ඇල්කේනවල ව්යුහාත්මක සමාවයවිකතාව මගින් සංලක්ෂිත වේ.
කාබන් ඇටසැකිල්ලේ සමාවයවිකතාව
කාබන් පරමාණු හතරක් හෝ වැඩි ගණනක් සහිත සමජාතීය කාබන් ඇටසැකිල්ලේ වෙනස්වීම් හේතුවෙන් ව්යුහාත්මක සමාවයවිකතාව මගින් සංලක්ෂිත වේ. මෙතිල් කාණ්ඩ -CH 2 දාමයේ ඕනෑම කාබන් වලට සම්බන්ධ වී නව ද්රව්ය සාදයි. දාමයේ කාබන් පරමාණු වැඩි වන තරමට සමාවයවික සමජාතීය සෑදිය හැක. සමලිංගික න්යායාත්මක සංඛ්යාව ගණිතමය වශයෙන් ගණනය කෙරේ.

සහල්. 1. මීතේන් සමජාතීය සමාවයවික ආසන්න සංඛ්යාව.
මෙතිල් කාණ්ඩ වලට අමතරව, දිගු කාබන් දාම කාබන් පරමාණුවලට සම්බන්ධ කළ හැකි අතර, සංකීර්ණ අතු සහිත ද්රව්ය සෑදෙයි.
ඇල්කේනවල සමාවයවිකතාව පිළිබඳ උදාහරණ:
- සාමාන්ය බියුටේන් හෝ n-බියුටේන් (CH 3 -CH 2 -CH 2 -CH 3) සහ 2-මෙතිල්ප්රොපේන් (CH 3 -CH(CH 3)-CH 3);
- n-pentane (CH 3 -CH 2 -CH 2 -CH 2 -CH 3), 2-methylbutane (CH 3 -CH 2 -CH(CH 3)-CH 3), 2,2-dimethylpropane (CH 3 -C (CH 3) 2 -CH 3);
- n-hexane (CH 3 -CH 2 -CH 2 -CH 2 -CH 2 -CH 3), 2-methylpentane (CH 3 -CH(CH 3)-CH 2 -CH 2 -CH 3), 3-methylpentane ( CH 3 -CH 2 -CH(CH 3)-CH 2 -CH 3), 2,3-ඩයිමෙතිල්බුටේන් (CH 3 -CH(CH 3)-CH(CH 3)-CH 3), 2,2-ඩයිමෙතිල්බුටේන් ( CH 3 -C(CH 3) 2 -CH 2 -CH 3).

සහල්. 2. ව්යුහාත්මක සමාවයවික සඳහා උදාහරණ.
ශාඛා සමාවයවික භෞතික ගුණවල රේඛීය අණු වලින් වෙනස් වේ. ශාඛා ඇල්කේන ඒවායේ රේඛීය සගයන්ට වඩා අඩු උෂ්ණත්වවලදී උණු වී උනු.
නාමකරණය
IUPAC ජාත්යන්තර නාමකරණය ශාඛා දාමයන් නම් කිරීම සඳහා නීති රීති ස්ථාපිත කර ඇත. ව්යුහාත්මක සමාවයවිකයක් නම් කිරීමට:
- දිගම දාමය සොයාගෙන එය නම් කරන්න;
- වඩාත්ම ආදේශක සමඟ අවසානයේ සිට ආරම්භ වන කාබන් පරමාණු;
- සංඛ්යාත්මක උපසර්ග භාවිතා කරමින් සමාන ආදේශක ගණන දක්වන්න;
- ආදේශක සඳහා නම් දෙන්න.
නම කොටස් හතරකින් සමන්විත වන අතර ඒවා එකිනෙක අනුගමනය කරයි:
- ආදේශක ඇති දාමයේ පරමාණු පෙන්නුම් කරන සංඛ්යා;
- සංඛ්යාත්මක උපසර්ග;
- නියෝජ්ය නම;
- ප්රධාන පරිපථයේ නම.
උදාහරණයක් ලෙස, CH 3 -CH (CH 3) -CH 2 -C (CH 3) 2 -CH 3 අණුවේ, ප්රධාන දාමයේ කාබන් පරමාණු පහක් ඇත. එබැවින් එය පංචස්කන්ධයකි. දකුණු කෙළවරේ වැඩිපුර අතු ඇති බැවින් පරමාණු අංකනය කිරීම ආරම්භ වන්නේ මෙතැන් සිටය. මෙම අවස්ථාවේ දී, දෙවන පරමාණුවට සමාන ආදේශක දෙකක් ඇත, එය නමෙන් ද පිළිබිඹු වේ. මෙම ද්රව්යය 2,2,4-ට්රයිමෙතිල්පෙන්ටේන් ලෙස හඳුන්වන බව පෙනී යයි.
විවිධ ආදේශක (මෙතිල්, එතිල්, ප්රොපයිල්) නම අකාරාදී ලෙස ලැයිස්තුගත කර ඇත: 4,4-ඩයිමෙතිල්-3-එතිල්හෙප්ටේන්, 3-මෙතිල්-3-එතිලොක්ටේන්.
සාමාන්යයෙන්, දෙකේ සිට හතර දක්වා සංඛ්යා උපසර්ග භාවිතා වේ: di- (දෙකක්), ට්රයි- (තුනක්), ටෙට්රා- (හතර).
අප ඉගෙන ගෙන ඇත්තේ කුමක්ද?
ඇල්කේන ව්යුහාත්මක සමාවයවිකතාව මගින් සංලක්ෂිත වේ. ව්යුහාත්මක සමාවයවික බියුටේන් වලින් ආරම්භ වන සියලුම සමජාතීය වල ලක්ෂණ වේ. ව්යුහාත්මක සමාවයවිකතාවේදී, ආදේශක කාබන් දාමයේ කාබන් පරමාණුවලට සම්බන්ධ වී සංකීර්ණ අතු දාම සාදයි. සමාවයවිකයේ නම සමන්විත වන්නේ ප්රධාන දාමයේ නම්, ආදේශක, ආදේශක සංඛ්යාව පිළිබඳ වාචික තනතුරක් සහ ආදේශක අමුණා ඇති කාබන් පරමාණුවල ඩිජිටල් තනතුරකි.
ඇල්කේන (පැරෆින් හෝ සංතෘප්ත හයිඩ්රොකාබන)- මූලද්රව්ය සංයුතිය අනුව කාබනික සංයෝගවල සරලම පන්තිය. ඒවා කාබන් සහ හයිඩ්රජන් වලින් සමන්විත වේ. මෙම පන්තියේ මුතුන් මිත්තන් මීතේන් CH 4 වේ. ඇල්කේන හා සම්බන්ධ අනෙකුත් සියලුම හයිඩ්රොකාබන සමජාතීය මීතේන් ශ්රේණියේ සාමාජිකයන් වේ. ඇල්කේන වල සාමාන්ය සූත්රය C n H 2 n +2
කාබන් එහි පිටත කවචයේ සංයුජතා ඉලෙක්ට්රෝන හතරක් ඇත, එබැවින් එයට හයිඩ්රජන් පරමාණු සමඟ ඉලෙක්ට්රෝන දෙකක සහසංයුජ බන්ධන හතරක් සෑදිය හැකිය:
ඉහළ සමජාතීය වෙත ගමන් කරන විට, සමාවයවික සංඛ්යාව තියුනු ලෙස වැඩි වේ (ඉහත බලන්න).
එක් යාබද කාබන් පරමාණුවකට බන්ධනය වූ කාබන් පරමාණුවක් ලෙස හැඳින්වේ ප්රාථමික, දෙකක් සමඟ - ද්විතියික, තුනක් සමඟ - තෘතියිකසහ හතරක් සමඟ - චතුරස්රාකාර:

ඇල්කේන නම් කිරීමට නාමකරණයන් කිහිපයක් භාවිතා කළ හැක: ඓතිහාසික හෝ සුළු නාමකරණය -මෙය බහුලව භාවිතා වන කාබනික සංයෝග සඳහා ඓතිහාසිකව ස්ථාපිත නම්වල සාරාංශයකි. – තාර්කික නාමකරණය.මෙම නාමකරණයට අනුව නමක් සම්පාදනය කිරීමේදී, සංයෝගය ඇල්කයිල් රැඩිකලුන් විසින් එහි ඇති හයිඩ්රජන් පරමාණු ප්රතිස්ථාපනය කිරීමේ ප්රතිඵලයක් ලෙස ශ්රේණියේ සරලම නියෝජිතයාගෙන් ලබාගත් ලෙස සලකනු ලැබේ.
 – IUPAC නාමකරණය
– IUPAC නාමකරණය
සමජාතීය මාලාවක්, එකම ක්රියාකාරී කණ්ඩායම් සහ එකම ව්යුහය සහිත කාබනික සංයෝගවල අනුපිළිවෙලක්, එහි එක් එක් සාමාජිකයා ස්ථිර ව්යුහාත්මක ඒකකයකින් (සමජාතීය වෙනස), බොහෝ විට මෙතිලීන් කණ්ඩායමක් -CH 2 - එහි අසල්වැසියාට වඩා වෙනස් වේ. සමජාතීය මාලාවක සාමාජිකයන් සමලිංගිකයන් ලෙස හැඳින්වේ. සමජාතීය ශ්රේණිවල, බොහෝ භෞතික ගුණාංග ස්වභාවිකව වෙනස් වේ. නිදසුනක් ලෙස, සෘජු දාම සංයෝග මාලාවක් මැද ඇති තාපාංක (C 5 -C 14) අසල්වැසි සමජාතීය අතර 20-30 ° C කින් වෙනස් වේ; සමජාතීය වෙනස -CH 2 - සෝඩියම් D-රේඛාව සඳහා දහන තාපය 630-640 kJ/mol සහ අණුක වර්තනය 4.6 කින් වැඩි වීමකට අනුරූප වේ. සමලිංගික ශ්රේණියේ ඉහළ සාමාජිකයින් තුළ, මෙම වෙනස්කම් ක්රමයෙන් සමනය වේ.
ඇල්කේනවල භෞතික හා රසායනික ගුණාංග. ඇල්කේන ලබා ගැනීම සහ හඳුනාගැනීම සඳහා ක්රම. තනි නියෝජිතයන්.
ඇල්කේනවල භෞතික ගුණාංග.
ශ්රේණියේ පළමු සාමාජිකයින් හතර - මීතේන්, ඊතේන්, ප්රොපේන් සහ බියුටේන් - කාමර තත්ව යටතේ වායූන් වේ. ඇල්කේන C 5 – C 15 ද්රව වන අතර C 16 සහ ඉන් ඔබ්බට ඝන වේ.
සාමාන්ය තත්ව යටතේ
ඇල්කේනවල රසායනික ගුණ
මීතේන් ශ්රේණියේ හයිඩ්රොකාබන සාමාන්ය උෂ්ණත්වවලදී රසායනිකව ඉතා නිෂ්ක්රීය වේ. ඔවුන් හයිඩ්රජන් එකතු නොකරයි (එබැවින් සීමා කිරීම), Cl 2 සහ Br 2 සමඟ ආරම්භයකින් තොරව ප්රතික්රියා නොකරන්න, පොටෑසියම් පර්මැන්ගනේට් සහ ක්රෝමික් අම්ලය වැනි ප්රබල ඔක්සිකාරක කාරක මගින් සීතල තුළ ඔක්සිකරණය නොවේ, ඒ අතරම, මෙම බන්ධන සාපේක්ෂ වේ රැඩිකලුන් සෑදීම සමඟ පහසුවෙන් සමජාතීය බෙදීම් වලට යටත් වේ. ඒක තමයි රැඩිකල් ආදේශන ප්රතික්රියා ඇල්කේන සඳහා වඩාත් පොදු වේ.
- හැලජනනය
ආලෝකයේ දී, ඇල්කේනවලට හයිඩ්රජන් පරමාණු අනුක්රමිකව හැලජන් පරමාණු සමඟ ප්රතිස්ථාපනය කළ හැකිය, උදාහරණයක් ලෙස:
හිදී උෂ්ණත්වය »500 °Cමීතේන් නයිට්රික් අම්ලය සහ නයිට්රජන් ඩයොක්සයිඩ් බලපෑම යටතේ නයිට්රේට් වේ:
- සල්ෆනේෂන්
සල්ෆියුරික් අම්ලය (ඔලියම්) රත් වූ විට ඇල්කේන සෙමෙන් සල්ෆෝනීකරණය කරයි තෘතියික සමගකාබන් පරමාණු:
- සල්ෆොක්ලෝරිනේෂන්
පාරජම්බුල කිරණවල බලපෑම යටතේ, ඇල්කේන SO 2 + Cl 2 මිශ්රණයක් සමඟ ආදේශන ප්රතික්රියාවකට භාජනය වේ:
- ඔක්සිකරණය
isoalkanes වලදී, CH තෘතීයික කාණ්ඩය සාපේක්ෂව පහසුවෙන් ඔක්සිකරණය වේ. කාර්මික උනන්දුව වන්නේ ඉහළ සන්තෘප්ත හයිඩ්රොකාබන C 8 - C 18 මිශ්රණයක උත්ප්රේරක ඔක්සිකරණයයි:
- විජලනය
t = 300 °C...400 °C දී, උත්ප්රේරකය හරහා ගමන් කරන ඇල්කේන හයිඩ්රජන් පරමාණු දෙකක් නැති වී ඇල්කේන බවට පත් වේ:
- සමාවයවිකීකරණය
අම්ල උත්ප්රේරකවල බලපෑම යටතේ (උදාහරණයක් ලෙස, AlCl 3, H 2 SO 4, ආදිය), ඇල්කේන කාබන් ඇටසැකිල්ල ප්රතිව්යුහගත කිරීමට සමත් වේ:
ඇල්කේන නිපදවීමේ ක්රම
- අසංතෘප්ත හයිඩ්රොකාබන හයිඩ්රජනීකරණය
- ඇල්කයිල් හේලයිඩ වලින් (වර්ට්ස් ප්රතික්රියාව, 1870)
- කාබොක්සිලික් අම්ල වලින්
- පෙට්රෝලියම් ඇල්කේනවල ඉරිතැලීම් සහ පයිෙරොලිසිස්:
5. ඇල්කේනස්. පොදු ලක්ෂණ: ව්යුහය, සමාවයවිකතාව, නාමකරණය.
ඇල්කීනවල සමජාතීය ශ්රේණිය එතිලීන් සමඟ ආරම්භ වේ. ඇල්කේනස්(olefins, ethylene hydrocarbons) - අණුවේ එක් ද්විත්ව බන්ධනයක් අඩංගු හයිඩ්රොකාබන. සාමාන්ය සූත්රය C n H 2n වේ.

සමාවයවිකතාව. නාමකරණය
සංතෘප්ත හයිඩ්රොකාබන ශ්රේණියේ මෙන්ම, ඇල්කීනවල ව්යුහාත්මක සමාවයවිකතාව ශ්රේණියේ සිව්වන සාමාජිකයා සමඟ ආරම්භ වේ. කෙසේ වෙතත්, සමාවයවික සංඛ්යාව වඩා විශාල වේ. ඔලෙෆින් වල සමාවයවිකතාව තීරණය වන්නේ කාබන් දාමයේ ව්යුහය අනුව, දෙවනුව, දාමයේ ද්විත්ව බන්ධනයේ පිහිටීම අනුව සහ තෙවනුව, ද්විත්ව බන්ධනයක් සහිත කාබන්වල පරමාණු හෝ කණ්ඩායම්වල අවකාශීය සැකැස්ම මගිනි.
ඇල්කේන විවිධ නාමකරණයන් මගින් හැඳින්වේ. සුළු නාමකරණයේදී, අනුරූප සන්තෘප්ත හයිඩ්රොකාබන් රැඩිකල් නාමයට -ene යන උපසර්ගය එකතු කරනු ලැබේ: එතිලීන්, ප්රොපිලීන්, බියුටිලීන්, අයිසොබියුටිලීන්, ඇමයිලීන් යනාදිය. තාර්කික නාමකරණයට අනුව, ඔලෙෆින් එතිලීන් වල ව්යුත්පන්නයන් ලෙස හැඳින්වේ. IUPAC නාමකරණය භාවිතයෙන් සංයෝගය නම් කිරීමේදී ද්විත්ව බන්ධනයක් අඩංගු දිගම කාබන් දාමය සංයෝගයේ කොඳු නාරටිය ලෙස තෝරා ගැනේ. නම පදනම් වී ඇත්තේ අවසානය සමඟ ඇල්කේනයේ නම මතය -an විසින් ප්රතිස්ථාපනය කර ඇත
-en. සංඛ්යාවෙන් දැක්වෙන්නේ ද්විත්ව බන්ධනයෙන් පසුව කාබන් පරමාණු සංඛ්යාවයි. ප්රධාන දාමයේ කාබන් පරමාණු ද්විත්ව බන්ධනය ආසන්නතම කෙළවරේ සිට අංකනය කළ යුතුය.
දිනය: ____________
11-11
ඇල්කේනස්. සමජාතීය ඇල්කේන මාලාව. ඇල්කේනවල නාමකරණය සහ සමාවයවිකතාව
විෂය
ඉලක්කය
සිසුන්ට සංතෘප්ත හයිඩ්රොකාබන සංකල්පය, ඒවායේ රසායනික, අවකාශීය සහ ඉලෙක්ට්රොනික ව්යුහය ලබා දීම. සමජාතීය සංකල්පය පිළිබඳව ඔබව හුරු කරවීම සඳහා, නවීන නාමකරණයට අනුව ද්රව්ය නම් කිරීම සහ සූත්ර සකස් කිරීම සඳහා වන නීති. දෘෂ්ටිවාදාත්මක සංකල්ප ගොඩනැගීම දිගටම කරගෙන යන්න: ස්වභාවධර්මය පිළිබඳ දැනුම, සංතෘප්ත හයිඩ්රොකාබනවල සංයුතිය, ව්යුහය, ගුණාංග සහ භාවිතය අතර ඇති හේතුව සහ බලපෑම සම්බන්ධය.
අන්තර්ගතය
ඇල්කේනවල සමජාතීය ශ්රේණි සහ ඒවායේ ව්යුහය
කොන්දේසි
ඇල්කේන්, සමලිංගික, සමාවයවික
CHEM අත්හදා බැලීම
උපකරණ
අන්තර් ක්රියාකාරී පුවරුව
නිවසේ කාර්යය
පාඩම් සැලැස්ම.
ගෙදර වැඩ සමීක්ෂණය. දැනුම යාවත්කාලීන කිරීම
ඇල්කේනස්. (සංතෘප්ත හයිඩ්රොකාබන. පැරෆින්. සන්තෘප්ත හයිඩ්රොකාබන.)
ඇල්කේන යනු අණු වල හයිඩ්රොකාබන වන අතර එහි සියලුම කාබන් පරමාණු තනි බන්ධන (-) මගින් සම්බන්ධ කර ඇති අතර සාමාන්ය සූත්රය ඇත:
සී n එච් 2n+2
සමලිංගික යනු කුමක්ද? (සිසුන් මෙම ප්රශ්නයට පිළිතුරු)
සමජාතීය ඇල්කේන මාලාව
ඇල්කේන, C සාමාන්ය සූත්රය සහිත n එච් 2 n +2 , යනු එකම ආකාරයේ ව්යුහයක් සහිත ආශ්රිත සංයෝග මාලාවක් වන අතර, එක් එක් ඊළඟ සාමාජිකයා පෙර පැවති එකට වඩා නියත පරමාණු සමූහයකින් වෙනස් වේ (-CH 2 -). මෙම සම්බන්ධතා අනුපිළිවෙල හැඳින්වේසමජාතීය මාලාවක් (ග්රීක භාෂාවෙන් සමලිංගික - සමාන), මෙම මාලාවේ තනි සාමාජිකයින් -සමලිංගික , සහ අසල්වැසි සමජාතීය වෙනස් වන පරමාණු සමූහය වේසමජාතීය වෙනස .
ඇල්කේනවල සමජාතීය ශ්රේණිය, පෙර දාමයට සෑම අවස්ථාවකදීම නව කාබන් පරමාණුවක් එක් කිරීමෙන් සහ එහි ඉතිරි සංයුජතා හයිඩ්රජන් පරමාණු 4ක් දක්වා එකතු කිරීමෙන් පහසුවෙන් සම්පාදනය කළ හැක. තවත් විකල්පයක් වන්නේ දාමයට -CH කණ්ඩායමක් එකතු කිරීමයි 2 -:
CH 4 හෝ N-CH 2 -H - සමජාතීය මාලාවේ පළමු සාමාජිකයා -මීතේන්
(කාබන් පරමාණු 1 ක් අඩංගු වේ);
CH 3 - CH 3 හෝ N-CH 2 -එස්එන් 2 -H - 2 වන සමලිංගික -ඊතේන් (පරමාණු 2 C);
CH 3 - CH 2 - CH 3 හෝ N-CH 2 -එස්එන් 2 -එස්එන් 2 -H - 3 වන සමලිංගික -ප්රොපේන් (3 C පරමාණු);
CH 3 - CH 2 - CH 2 - CH 3 හෝ N-CH 2 -එස්එන් 2 -එස්එන් 2 - CH 2 - N -බියුටේන් (4 C පරමාණු)
උපසර්ගය-an සියලුම ඇල්කේන වල නම් වල ලක්ෂණයකි. පස්වන සමලිංගිකයේ සිට, ඇල්කේනයේ නම සෑදී ඇත්තේ ග්රීක ඉලක්කම් වලින් වන අතර, එය අණුවේ ඇති කාබන් පරමාණු ගණන සහ උපසර්ගය දක්වයි.-an : පෙන්ටේන් සී 5 එන් 12 , හෙක්සේන් සී 6 එන් 14 , හෙප්ටේන් සී 7 එන් 16 , ඔක්ටේන් සී 8 එන් 18 , නෝනාන් සී 9 එන් 20 , ඩීන් සී 10 එන් 22 ආදිය
ඇල්කේන සඳහා සමාවයවිකතා වර්ග:
සමාවයවිකතාව යනු එකම සංයුතිය (එකම අණුක සූත්රය) ඇති නමුත් විවිධ ව්යුහයන් ඇති සංයෝගවල පැවැත්මේ සංසිද්ධියයි. එවැනි සම්බන්ධතා ලෙස හැඳින්වේසමාවයවික .
අණු (එනම් රසායනික ව්යුහය) තුළ පරමාණු ඒකාබද්ධ වන අනුපිළිවෙලෙහි වෙනස්කම් වලට තුඩු දෙයිව්යුහාත්මක සමාවයවිකතාව . ව්යුහාත්මක සමාවයවිකවල ව්යුහය ව්යුහාත්මක සූත්ර මගින් පිළිබිඹු වේ. ඇල්කේන මාලාවේ, දාමයේ කාබන් පරමාණු 4ක් හෝ වැඩි ගණනක් අඩංගු වන විට ව්යුහාත්මක සමාවයවිකතාව දිස්වේ, එනම් බියුටේන් C වලින් ආරම්භ වේ. 4 එන් 10 . එකම සංයුතියේ සහ එකම රසායනික ව්යුහයේ අණුවල අභ්යවකාශයේ පරමාණුවල විවිධ සාපේක්ෂ පිහිටීම් හැකි නම්, අපි නිරීක්ෂණය කරමු.අවකාශීය සමාවයවිකවාදය (stereoisomerism) . මෙම අවස්ථාවේ දී, ව්යුහාත්මක සූත්ර භාවිතය ප්රමාණවත් නොවන අතර අණුක ආකෘති හෝ අවකාශීය (stereochemical) සූත්ර භාවිතා කළ යුතුය. ඇල්කේනස්, ඊතේන් සී වලින් ආරම්භ වේ 2 එන් 6 , C-C s-බන්ධන ඔස්සේ අන්තර් අණුක භ්රමණය හේතුවෙන් විවිධ අවකාශීය ආකාරවලින් පවතින අතර ඊනියා ප්රදර්ශනය කරයිභ්රමණ සමාවයවිකතාව .
මීට අමතරව, අණුවක කාබන් පරමාණු 7ක් හෝ වැඩි ගණනක් තිබේ නම්, වෙනත් ආකාරයක අවකාශීය සමාවයවිකතාවක් ඇති කළ හැකිය, සමාවයවික දෙකක් වස්තුවක් ලෙස සහ එහි දර්පණ රූපය (වම් අත දකුණට සම්බන්ධ වන ආකාරය හා සමාන) ලෙස එකිනෙකට සම්බන්ධ වන විට.
අණු වල ව්යුහයේ එවැනි වෙනස්කම් ලෙස හැඳින්වේකැඩපත හෝදෘශ්ය සමාවයවිකතාව.
ඇල්ගොරිතම.
1. ප්රධාන පරිපථ තේරීම:

2. ප්රධාන දාමයේ පරමාණු සංඛ්යාව:

3. නම ගොඩනැගීම:

2 - මෙතිල්බුටේන්
ඇල්කේන වල ව්යුහය.
සියලුම කාබනික ද්රව්යවල කාබන් පරමාණුව "උද්දීපනය වූ" තත්වයක පවතී, එනම්, බාහිර මට්ටමේ යුගල නොකළ ඉලෙක්ට්රෝන හතරක් ඇත.
සෑම ඉලෙක්ට්රෝන වලාකුළකටම ශක්ති සංචිතයක් ඇත: s-වලාකුළට p-වලාකුළට වඩා කුඩා ශක්ති සංචිතයක් ඇත, ඒවා විවිධ ශක්ති තත්ත්වයන් තුළ පවතී. එබැවින්, රසායනික බන්ධනයක් සෑදූ විට, දෙමුහුන්කරණය සිදු වේ, එනම් බලශක්ති සංචිතය අනුව ඉලෙක්ට්රෝන වලාකුළු පෙළගැස්වීම. මෙය වලාකුළු වල හැඩය සහ දිශාවෙන් පිළිබිඹු වේ ඉලෙක්ට්රෝන වලාකුළු වල ප්රතිව්යුහගත කිරීමක් (අවකාශීය) සිදුවේ.
sp3 දෙමුහුන්කරණයේ ප්රතිඵලයක් ලෙස, සංයුජතා ඉලෙක්ට්රෝන වලාකුළු හතරම දෙමුහුන් කර ඇත: දෙමුහුන් වලාකුළු වල මෙම අක්ෂ අතර බන්ධන කෝණය 109° 28" වේ, එබැවින් අණුවලට අවකාශීය tetrahedral හැඩයක් ඇත, කාබන් දාමවල හැඩය Zigzag වේ; කාබන් පරමාණු එකම සරල රේඛාවක නොමැත, මන්ද භ්රමණ පරමාණු බන්ධන කෝණ එලෙසම පවතී.
සියලුම කාබනික ද්රව්ය ප්රධාන වශයෙන් ගොඩනගා ඇත්තේ සහසංයුජ බන්ධන මගිනි. කාබන්-කාබන් සහ කාබන්-හයිඩ්රජන් බන්ධන සිග්මා බන්ධන ලෙස හැඳින්වේ - පරමාණුක න්යෂ්ටීන් හරහා ගමන් කරන රේඛාවක් ඔස්සේ පරමාණුක කාක්ෂික අතිච්ඡාදනය වන විට සෑදෙන බන්ධනයකි. මෙම බන්ධනයට අක්ෂීය සමමිතිය ඇති බැවින් සිග්මා බන්ධන වටා භ්රමණය විය හැක.
ද්රව්ය ඒකාබද්ධ කිරීම සඳහා, ඡේදයේ අවසානයේ ඇති ප්රශ්නවලට පිළිතුරු සැපයීම මෙන්ම ගැටළු පොතේ කාර්යයන් සම්පූර්ණ කරන්න
ගෙදර වැඩ: §3.1 නැවත කියවීම, අංක 3,4,6,8 පි 67